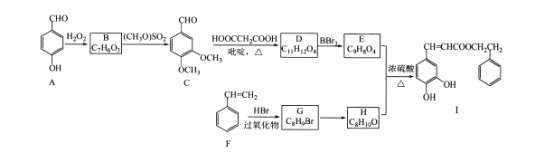
题目内容
【题目】某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是
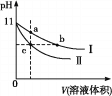
A. Ⅱ为氨水稀释时的pH变化曲线 B. a、b、c三点溶液的导电性:c>b=a
C. a、b、c三点溶液中水的电离程度:c=b>a D. a、b、c三点溶液的KW:c=b<a
【答案】C
【解析】
根据信息可知氢氧化钠溶液和氨水具有相同的体积和pH,由于氢氧化钠是强电解质,则氢氧化钠的浓度小,再利用两溶液在稀释时强碱的变化程度来分析解答即可。
A.由图可知,开始的pH相同,在稀释时由氮水的电离平衡可知,促进氨水的电离,则氮水中的离子浓度大,即I是氯水的pH变化曲线,故不符合题意;
B.由图可知,开始的pH相同,开始时氮水浓度大,稀释相同倍数,氮水的浓度仍然大,氮水中离子浓度也大,所以导电性a>c,对于氢氧化钠溶液,稀释后离子浓度减小,导电性变小,即a>b,故不符合题意;
C.由于氮水是弱电解质,氢氧化钠是强电解质,稀释相同倍数后,氮水的碱性强于氢氧化钠,所以氢水中水的电离程度小于氢氧化钠,而b、c两点的pH值相同,所以水电离的程度也相同,所以水的电离程度:c=b>a,故符合题意;
D.KW是温度的函数,a、b、c三点溶液温度相同,所以水的离子积常数不变,即c=b=a,故不符合题意;
故选C。

练习册系列答案
相关题目