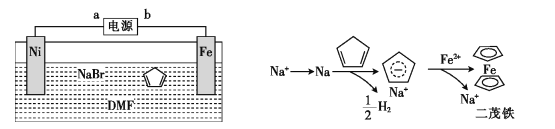
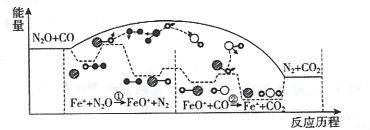
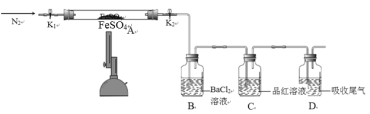
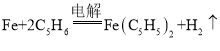题目内容
【题目】以含1个碳原子物质(如CO、CO2、CH4、CH3OH等)为原料的“碳一化学”处于未来化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、CH3OH(g)的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-l、-764.5kJ·mol-l。则反应I:CO(g)+2H2(g)=CH3OH(g)△H=___
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I,反应达到平衡时,CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
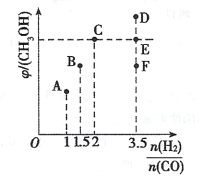
①当起始n(H2)/n(CO)=1时,从反应开始到平衡前,CO的体积分数将___(填“增大”、“减小”或“不变”)。
②当起始n(H2)/n(CO)=2时,反应经过l0min达到平衡,CO转化率为0.5,则0~l0min内平均反应速率v(H2)=___。
③当起始n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的__。(填“D”、“E”或“E”点)。
(3)在一容积可变的密闭容器中充有10molCO和20molH2,发生反应I。CO的平衡转化率(α)与温度(T)、压强(P)的关系如下图所示。
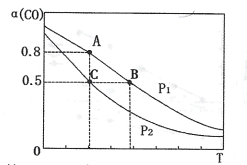
①压强P1=___(填“<”、“=”或“>”)P2;A、B、C三点的平衡常数KA、KB、KC的大小关系为___(用“<”、“=”或“>”表示)。
②若达到平衡状态C时,容器体积为10L,则在平衡状态A时容器体积为____L。
【答案】-90.1kJ/mol 不变 0.05mol·L-1·min-1 F > KA=KC>KB 2
【解析】
(1)CO、H2、CH3OH(g)的燃烧热化学方程式分别为:
①![]() ,
,
②![]() ,
,
③![]() ,根据盖斯定律可知,将①+2×②-③可得:
,根据盖斯定律可知,将①+2×②-③可得:![]() ;
;
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I![]() ;
;
①当起始n(H2)/n(CO)=1时,则n(H2)=n(CO)=1.5mol,CO的体积分数为50%,根据三等式
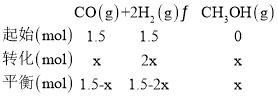
平衡时,CO的体积分数为![]() ,不管CO转化了多少,CO的体积分数一直为50%,则反应前后体积分数不变;
,不管CO转化了多少,CO的体积分数一直为50%,则反应前后体积分数不变;
②当起始n(H2)/n(CO)=2时,混合气体为3mol,则n(CO)=1mol,n(H2)=2mol,反应经过l0min达到平衡,CO转化率为0.5,即转化了0.5mol,则H2转化1mol,则0~l0min内平均反应速率v(H2)=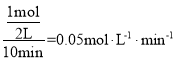 ;
;
③当反应物的投料比等于其化学计量数之比时,平衡时,生成物的体积分数最大,即当起始n(H2)/n(CO)=2时,CH3OH(g)的体积分数(φ)最大,因此当起始n(H2)/n(CO)= 3.5时,达到平衡后,CH3OH的体积分数可能是图像中的F点;
(3)①当温度相同时,增大压强,平衡正向移动,CO转化率上升,由此可知P1>P2;该反应正向为放热反应,升高温度,平衡将逆向移动,平衡常数将减小,平衡常数只与温度有关,温度不变时,平衡常数不变,A和C的温度相同,小于B的温度,因此KA=KC>KB;
②平衡状态A和C的温度相同,平衡常数相同。达到平衡状态C时,CO的转化率为50%,则平衡时n(CO)=5mol,n(H2)=10mol,n(CH3OH)=5mol,平衡常数![]() ,达到平衡状态A时,CO的转化率为80%,则平衡时n(CO)=2mol,n(H2)=4mol,n(CH3OH)=8mol,设该容器体积为VL,则
,达到平衡状态A时,CO的转化率为80%,则平衡时n(CO)=2mol,n(H2)=4mol,n(CH3OH)=8mol,设该容器体积为VL,则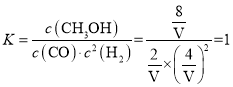 ,解得V=2。
,解得V=2。

【题目】Ⅰ.(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
Ⅱ.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρ g·cm-3,计算该溶液的浓度(用以上字母表示)。
(1)该溶液的物质的量浓度________________
(2)该溶液的质量分数_________________________
Ⅲ.有两份溶液,其中所含溶质相同,设其摩尔质量为M g·mol-1。根据下表信息,回答有关问题:
溶质的质量分数 | 溶液的密度(g·cm-3) | |
第一份溶液 | w1 | ρ1 |
第二份溶液 | w2 | ρ2 |
(1)取等质量两份溶液混合,则所得混合液中溶质的质量分数w3=________。(用以上字母表示)
(2)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,若ρ1>ρ2,则w3___w4;若ρ1<ρ2,w3______w4(填“>”“<”或“=”)。