题目内容
【题目】某化学实验室需要0.2 mol·L-1的NaOH溶液450 mL和0.5 mol·L-1的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
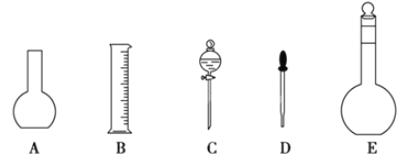
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的__(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是__(用字母表示,每个字母只能用一次)。
A 用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B 准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50 mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C 将容量瓶盖紧,摇匀
D 将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E 改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F 继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(4)根据计算,配制上述NaOH溶液需 NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__。
【答案】AD 玻璃棒胶头滴管 ①③⑥ BDAFEC 4.0 常将浓硫酸沿器壁慢慢注入水中,并不断搅拌
【解析】
(1)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;配制溶液需要五种玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、容量瓶;
(2)根据容量瓶的结构分析;
(3)配制一定物质的量浓度溶液的步骤:计算、称量、稀释、冷却、移液、定容、摇匀、装瓶等,据此排序;
(4)依据m=CVM计算解答;
(5)依据浓硫酸稀释的正确操作答题;
(1)配制溶液的操作步骤:首先计算出需要的溶质的质量(浓硫酸体积),然后天平称量(量筒量取),后放入烧杯中溶解(稀释),同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.在此过程中用到的仪器有:天平、量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,还缺少的仪器有:胶头滴管、玻璃棒,不需要的是:平底烧瓶和分液漏斗;
(2)根据容量瓶的结构,容量瓶上标有以下温度、容量、刻度线;
故选:①③⑥;
(3)配制一定物质的量浓度溶液的步骤:计算、称量、稀释、冷却、移液、定容、摇匀、装瓶等,所以正确的顺序为:BDAFEC;
(4)依据m=CVM计算解答要用500mL容量瓶,配制0.2mol·L-1 NaOH溶液500mL需 NaOH固体的质量为:0.2mol·L-1×40g·mol-1×0.5L=4.0g;
(5)浓硫酸稀释产生大量的热,稀释的正确操作为:将浓硫酸沿着烧杯壁缓缓注入水中,同时不断用玻璃棒搅拌;

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)==CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) △H2=-41.2kJ/mol
T1°C时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
请回答下列问题:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
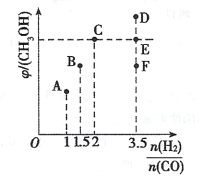
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=_____
(2)30s时CH4的转化率为_______,20~40s,v(H2)=_______.
(3)T2°C时,该反应的化学平衡常数为1.5,则T2___T1(填“>”“=”或 “<”。)
(4)T1°C时反应③达到平衡的标志为______________。
A.容器内气体密度不变 B.体系压强恒定
C.CO和H2的体积分数相等且保持不变 D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后/span>,其他条件不变,在70 s时再加入2 molCH4和1molCO2,此刻平衡的移动方向为________(填“不移动”“正向”或“逆向"),重新达到平衡后,CO2的总转化率比原平衡____________(填“大”“小”或“相等”)。