题目内容
【题目】Ⅰ.(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
Ⅱ.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρ g·cm-3,计算该溶液的浓度(用以上字母表示)。
(1)该溶液的物质的量浓度________________
(2)该溶液的质量分数_________________________
Ⅲ.有两份溶液,其中所含溶质相同,设其摩尔质量为M g·mol-1。根据下表信息,回答有关问题:
溶质的质量分数 | 溶液的密度(g·cm-3) | |
第一份溶液 | w1 | ρ1 |
第二份溶液 | w2 | ρ2 |
(1)取等质量两份溶液混合,则所得混合液中溶质的质量分数w3=________。(用以上字母表示)
(2)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,若ρ1>ρ2,则w3___w4;若ρ1<ρ2,w3______w4(填“>”“<”或“=”)。
【答案】64 30 g·mol-1 44 g·mol-1 1000a/22.4V 17a/22.4Vρ×100% (w1+w2)/2 < >
【解析】
Ⅰ.(1) 根据n=![]() =
=![]() 计算;
计算;
(2) 根据同温同压下体积之比等于物质的量之比计算;
(3) 根据T、V相同时,压强之比等于物质的量之比进行计算;
Ⅱ. (1) 根据c=![]() 计算所得氨水的物质的量浓度;
计算所得氨水的物质的量浓度;
(2) 根据ω=![]() ×100%计算氨水中溶质的质量分数;
×100%计算氨水中溶质的质量分数;
Ⅲ. (1)利用溶质质量分数的计算公式,分别计算出溶质的量与溶剂的量进行计算即可;
(2) 此题是一道讨论题,解题时计算出ω4的表达式与ω3比较,结合数学上关于比较大小的方法解决即可。
Ⅰ.(1) n=![]() =0.03mol,M=
=0.03mol,M=![]() =64g/mol,则相对分子质量为64;
=64g/mol,则相对分子质量为64;
(2) 在T、P相同时,体积之比等于物质的量之比,即15:8=![]() :
:![]() ,解得M(A)=30g/mol;
,解得M(A)=30g/mol;
(3) 在T、V相同时,压强之比等于物质的量之比,即4:11=![]() :
:![]() ,解得:M(A)=44g/mol;
,解得:M(A)=44g/mol;
Ⅱ. (1) 所得氨水中溶液的物质的量浓度为:c=![]() =
=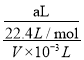 =
=![]() mol/L;
mol/L;
(2) 氨气溶于水,主要以NH3H2O存在,但仍然以NH3作为溶质,ω=![]() ×100%=
×100%=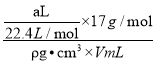 ×100%=
×100%=![]() ×100%;
×100%;
Ⅲ.(1) 设 两份溶液中所含的溶质分别为M1、M2,有: M1=m×ω1,M2=m×ω2,ω3=![]() ×100%=
×100%=![]() ×100%,即取等质量两份溶液混合,则所得混合液中溶质的质量分数为
×100%,即取等质量两份溶液混合,则所得混合液中溶质的质量分数为![]() ×100%;
×100%;
(2) 取等体积的两份溶液混合,则设其体积为V,则溶液的质量分别为M3![]() ×100%=
×100%=![]() =
=![]() =
=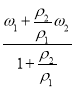 ,因为ω1>ω2,若ρ1>ρ2,则ω3<ω4;若ρ1<ρ2,则ω3>ω4。
,因为ω1>ω2,若ρ1>ρ2,则ω3<ω4;若ρ1<ρ2,则ω3>ω4。