题目内容
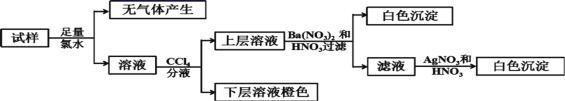
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是____杂化,CB3分子的空间构型为____。
(2)C的氢化物极易溶于水的原因是____。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:____(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为____。
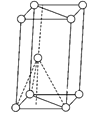
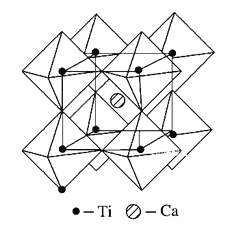
(5)X与Y所形成化合物晶体的晶胞如图所示。
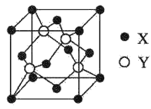
①在一个晶胞中,X离子的数目为____;
②若该化合物的密度为ag·cm-3,则晶胞的体积是____cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
【答案】sp3 四面体形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应 C1>P>S ![]() 或
或![]() 4
4 ![]() 或
或![]()
【解析】
略

【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
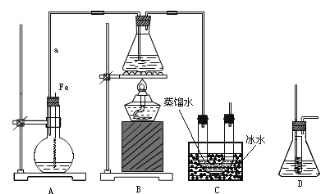
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下 表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为______。
(2)导管a的作用是______。
(3)反应完毕后,U形管内的现象是______;分离溴乙烷时所需的玻璃仪器是______。
(4)简述实验中用纯铁丝代替铁粉的优点:______。
(5)实验完成后,某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解 反应还是消去反应,该同学设计了甲、乙两个方案:
方案甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
方案乙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案的叙述(_____)
A 方案甲正确 B 方案乙正确 C 两个方案都不正确
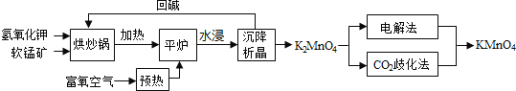
【题目】某研究性学习小组在网上收集到如下信息:以贫软锰矿和有色金属冶炼厂的![]() 废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为
废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为![]() 和少量
和少量![]() 、
、![]() 、
、![]() 等杂质.工艺流程如图1:
等杂质.工艺流程如图1:

已知:有关氢氧化物沉淀pH对应表
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
氢氧化铁 |
|
|
氢氧化铝 |
|
|
氢氧化亚铁 |
|
|
请回答:
![]() 在浸出液除杂过程中需通入适量空气并调节溶液的pH到
在浸出液除杂过程中需通入适量空气并调节溶液的pH到![]() ,沉淀部分杂质离子,此时滤渣I中主要含有 ______
,沉淀部分杂质离子,此时滤渣I中主要含有 ______ ![]() 填化学式
填化学式![]() .
.
![]() 影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质
影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质![]() 造成锰损失.温度对浸锰率的影响见图2、图3.
造成锰损失.温度对浸锰率的影响见图2、图3.
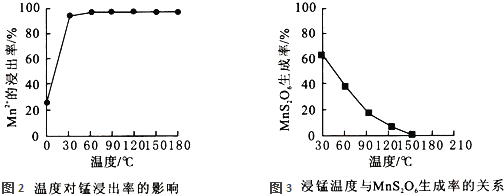
为了提高锰的浸出率,请选择合适的条件 ______ ![]() 填序号
填序号![]()
![]() 以上
以上
![]() 在滤液中加入
在滤液中加入![]() 生成
生成![]() 的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______
的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______ ![]() 若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
![]() 现有含锰质量分数为
现有含锰质量分数为![]() 的贫锰矿1吨,若按照上述工艺锰的产率为
的贫锰矿1吨,若按照上述工艺锰的产率为![]() ,最终获得碳酸锰的质量 ______ .
,最终获得碳酸锰的质量 ______ .