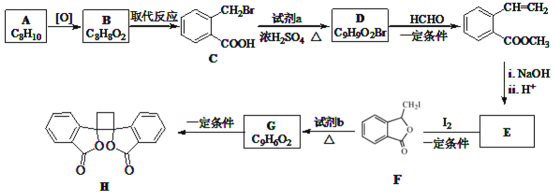
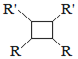
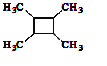
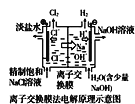
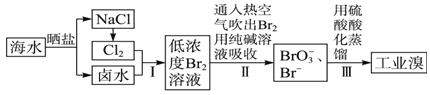
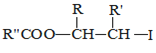题目内容
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
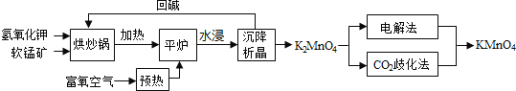
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
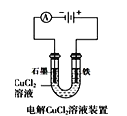
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
【答案】增大反应物接触面积,加快反应速率,提高原料利用率 ![]() 增大反应物氧气的浓度,可使化学速率加快,增加软锰矿转化率
增大反应物氧气的浓度,可使化学速率加快,增加软锰矿转化率 ![]()
![]()
![]() :2
:2 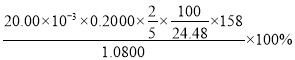
【解析】
软锰矿氢氧化钾按比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,提高反应速率,加热通入预热的空气,在“平炉”中发生反应2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O,生成物质水浸沉降析出晶体得到锰酸钾,CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和KHCO3,“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-,以此解答该题。
2K2MnO4+2H2O,生成物质水浸沉降析出晶体得到锰酸钾,CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和KHCO3,“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-,以此解答该题。
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率;
![]() 流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:
流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:![]() ;
;
![]() “平炉”中加压,增大反应物氧气的浓度,能提高反应速率增加软锰矿转化率;
“平炉”中加压,增大反应物氧气的浓度,能提高反应速率增加软锰矿转化率;
![]() 在
在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成
发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成![]() ,
,![]() 和
和![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,在电解槽中阳极,
水溶液,在电解槽中阳极,![]() 失去电子,发生氧化反应,产生
失去电子,发生氧化反应,产生![]() ,电极反应式是:
,电极反应式是: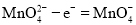 ;
;
![]() 依据电解法方程式
依据电解法方程式![]() ,可知
,可知![]() 的理论利用率是
的理论利用率是![]() ,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中
,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中![]() 的理论利用率是
的理论利用率是![]() ,所以二者的理论利用率之比为3:2;
,所以二者的理论利用率之比为3:2;
![]() 依据离子方程式
依据离子方程式![]() ,可知
,可知![]() 与草酸反应的定量关系是
与草酸反应的定量关系是![]() ,
,![]() ,
,![]() ,
,![]() 样品中
样品中![]() ,
,![]() 样品中
样品中![]() ,样品的纯度
,样品的纯度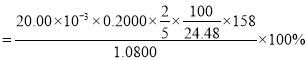 。
。

 科学实验活动册系列答案
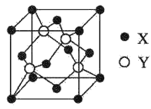
科学实验活动册系列答案【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,为确定其成分,完成了如下实验
中的几种,为确定其成分,完成了如下实验![]() 已知:
已知:![]()
![]() 根据实验现象,所得结论错误的是
根据实验现象,所得结论错误的是![]()
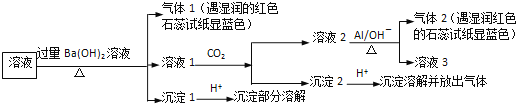
A.沉淀1加酸部分溶解,则含![]() 和
和![]()
B.可能含![]() 、
、![]()
C.沉淀2加酸溶解,则含![]()
D.气体1遇水显碱性,则含![]()
【题目】某学生用0.2000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A、量取20.0ml待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B、用标准溶液润洗滴定管2-3次;
C、取盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D、取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm-3cm;
E、调节液面至“0”或“0”以下刻度并记下读数;
F、把锥形瓶放在滴定管的下面,用NaOH溶液滴定至终点并记下滴定管液面的刻度
据此实验完成填空:
(1)正确操作步骤的顺序是___。(用序号字母填写)
(2)用标准的NaOH溶液滴定待测盐酸时,左手握碱式滴定管的带有玻璃球的橡胶管部分,右手摇动锥形瓶,眼睛注视___。判断滴定终点的方法是___。
(3)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测液 体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 1.20 | 23.20 |
①根据上述数据,可计算出该盐酸的浓度为___(保留两位有效数字).
②在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___(填字母序号)
A.滴定终点读数时俯视读数
B.碱式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失