题目内容
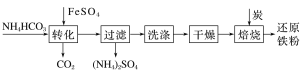
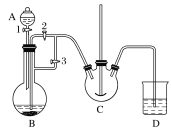
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
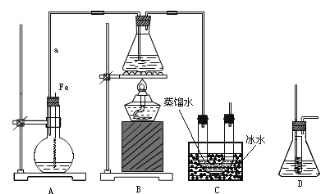
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下 表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为______。
(2)导管a的作用是______。
(3)反应完毕后,U形管内的现象是______;分离溴乙烷时所需的玻璃仪器是______。
(4)简述实验中用纯铁丝代替铁粉的优点:______。
(5)实验完成后,某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解 反应还是消去反应,该同学设计了甲、乙两个方案:
方案甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
方案乙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案的叙述(_____)
A 方案甲正确 B 方案乙正确 C 两个方案都不正确
【答案】C2H5OH+HBr![]() C2H5Br+H2O 导气、冷凝、回流 U形管底部产生无色的油状液体 分液漏斗、烧杯 随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝 C
C2H5Br+H2O 导气、冷凝、回流 U形管底部产生无色的油状液体 分液漏斗、烧杯 随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝 C
【解析】
(1)HBr和乙醇在加热条件下,发生取代反应生成目标产物溴乙烷和水;
(2)导管a的作用是导气、冷凝、回流;
(3)根据表格数据,难溶于水,易溶于有机溶剂,据此分析;溴乙烷与水蒸气不相溶;
(4)结合可随时控制反应进行分析;
(5)方案甲:反应后的溶液中有氢氧化钠,溴能够与氢氧化钠反应褪色;
方案乙:溶液中有溴离子存在,溴离子能够被高锰酸钾溶液氧化,以此来解答。
(1)HBr和乙醇在加热条件下,发生取代反应生成目标产物溴乙烷和水,B中发生反应生成目标产物的化学方程式为C2H5OH+HBr![]() C2H5Br+H2O;
C2H5Br+H2O;
(2)导管a的作用是导气、冷凝、回流;
(3)反应完毕后,U形管内的现象是底部有油状液体;溴乙烷与水蒸气不相溶,混合物可利用分液操作进行分离,需要的玻璃仪器有分液漏斗和烧杯;
(4)实验中用纯铁丝代替铁粉的优点:可随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝,而铁粉添加后就无法控制反应速率;
(5)方案甲:由于反应后的溶液中存在氢氧化钠,氢氧化钠能够与溴能够反应使溴水褪色,所以无法证明反应类型,故方案甲错误;
方案乙:由于两种反应的溶液中都有溴离子存在,溴离子能够被高锰酸钾溶液氧化,所以无法判断反应类型,故方案乙错误;
答案选C。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
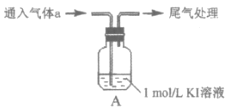
【题目】某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
实验 | 气体a | 编号及现象 |
| HCl | Ⅰ.溶液迅速呈黄色 |
SO2 | Ⅱ.溶液较快呈亮黄色 | |
CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
空气 | Ⅳ.长时间后,溶液无明显变化 |
(1)实验Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
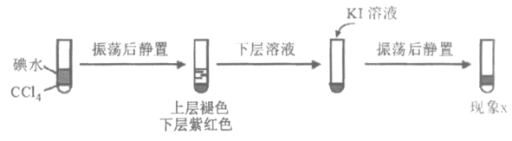
现象x是______________。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________。
假设2:O2只氧化了SO2,化学方程式是______________。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
电解时间/min | 溶液 | 阳极 | 阴极 |
t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
| 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
结合化学反应,解释上表中的现象:______________。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________。