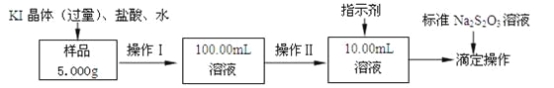
题目内容
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-、Br-、
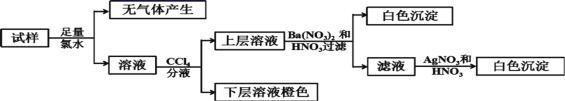
、Cl-、Br-、![]() 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
A.Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在
肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含![]() 和
和![]()
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含![]() 需另做实验判断
需另做实验判断
【答案】A
【解析】
溶液为无色,则一定不含Fe3+;往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成,则溶液中无SO42-;原溶液加足量氯水,无气体产生,则原溶液中无CO32-;流程中第二步加CCl4分液后下层为橙色,则溶液中必含Br-;上层溶液加Ba(NO3)2和HNO3后产生白色沉淀,且溶液中无SO42-,则溶液中含SO32-,则溶液无Ba2+;c(Br-)+2c(SO32-)=0.1mol/L+2×0.1mol/L=0.3mol/L,因为离子浓度都为0.1mol/L,则结合电荷守恒必有Na+、K+、![]() 且无c(Cl-),综上所述,一定含有Na+、K+、
且无c(Cl-),综上所述,一定含有Na+、K+、![]() 、Br-、SO32-,一定不含Ba2+、Fe3+、
、Br-、SO32-,一定不含Ba2+、Fe3+、![]() 、
、![]() 、Cl-,据此解答。
、Cl-,据此解答。
A.由分析可知,Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在,A正确;
肯定不存在,Na+、K+肯定存在,A正确;
B.溶液中一定含SO32-,B错误;
C.因流程中第一步加了足量氯水,所以溶液中的SO32-在第一步就已经被氧化成SO42-,步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,C错误;
D.因离子浓度都为0.1mol/L,根据电荷守恒有:0.3mol/L=c(Br-)+2c(SO32-)=c(Na+)+c(K+)+ c(NH4+),溶液中一定含NH4+,D错误。
答案选A。

 名校课堂系列答案
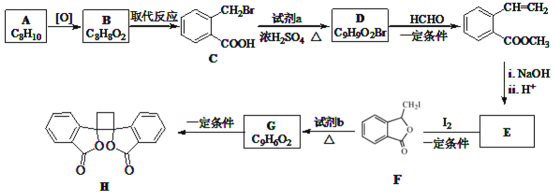
名校课堂系列答案【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
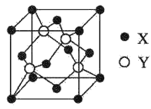
(5)晶体有两种晶胞,如图1、图2所示。

图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
【题目】(1)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
aA(g) |
| bB(g) |
| 2C(g) | |
起始物质的量浓度/(mol·L-1): | 1.5 | 1 | 0 | ||
2s末物质的量浓度/(mol·L-1): | 0.9 | 0.8 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为__。
②用物质B来表示0~2s的平均反应速率为__。
③从反应开始到2s末,A的转化率为__。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是__(填序号)
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是__。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图,该燃料电池工作时,电池的总反应方程式为__;负极的电极反应式为__。