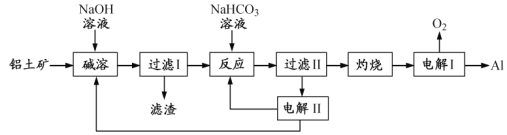
题目内容
【题目】自然界存在的元素中,金属元素种类更多,非金属元素丰度更大。
Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子的价电子排布图是_____________,N2F2分子中N原子的杂化方式是_______,1 mol N2F2含有________个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N____(填“>”、“<”或“=”)Si-N-Si,原因_________。
Ⅱ.金属元素在现代工业中也占据极其重要的地位。其中钛也被称为“未来的钢铁”,具有质轻、抗腐蚀、硬度大,是宇航、航海、化工设备等的理想材料,是一种重要的战略资源,越来越受到各国的重视。
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图所示,为________(填堆积方式)堆积。

(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。化合物乙的沸点明显高于化合物甲,主要原因是__________。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________________。

(5)钙钛矿晶体的结构如图所示。假设把氧离子看作硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,钙离子位于立方晶胞的体心,一个钙离子被________个氧离子包围。钙钛矿晶体的化学式为________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm。

【答案】![]() sp2 1.806×1024 > Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N。键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′ 22 六方最密 化合物乙形成分子间氢键 O>N>C 12 CaTiO3
sp2 1.806×1024 > Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N。键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′ 22 六方最密 化合物乙形成分子间氢键 O>N>C 12 CaTiO3 ![]() a
a
【解析】
Ⅰ.(1)根据构造原理书写基态N原子的价电子排布式,然后根据同一电子层各个轨道电子尽可能成单排列,而且自旋方向相同书写电子排布图,N2F2分子中N原子之间形成N=N双键,N原子与F原子之间形成N-F键,N原子含有1对孤对电子;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
II.(3)在任何一种核外电子没有运动状态完全相同的电子;根据金属钛晶胞结构分析其所属金属晶体类型堆积方式;
(4)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,根据同一周期元素电负性变化规律分析判断;
(5)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊法计算图中立方体中各原子数目确定化学式;若氧离子半径为a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2apm,Ti位于正方形的中心,两个钛离子间最短距离等于正方形对角线长度。
Ⅰ.(1)N是7号元素,根据构造原理可知基态N原子的核外电子排布式是1s22s22p3,其基态价电子排布式是2s22p3,在2p亚层上有3个轨道,由于电子尽可能成单排列,而且自旋方向相同,所以N基态价电子排布图为:![]() ;N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,lmol N2F2含有3molσ键,即1.806×1024个σ键;
;N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,lmol N2F2含有3molσ键,即1.806×1024个σ键;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′;N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′;
II.(3)Ti原子核外有22个电子,则Ti原子核外共有22种运动状态不同的电子;由金属钛晶胞结构可知,金属钛属于六方最密堆积;
(4)化合物甲只存在分子间作用力,而化合物乙除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,因此化合物乙的沸点比化合物甲高,在化合物乙中C、N、O三种原子的杂化轨道均为sp3杂化,这三种元素位于同一周期,由于同一周期元素从左到右元素的电负性逐渐增大,所以三种元素的电负性:O>N>C;
(5)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围,一个钙离子周围离Ca2+距离最近且相等的O2-有12个,分别位于晶胞的12个棱中心,故一个钙离子被12个氧离子包围;在该晶胞中含有Ca2+数目为1个,含有Ti原子数为8×![]() =1,含有的O2-数目为12×
=1,含有的O2-数目为12×![]() =3,所以该晶体化学式为CaTiO3;
=3,所以该晶体化学式为CaTiO3;
若O2-半径为a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2apm,Ti位于正方形的中心,两个钛离子间最短距离正方形对角线长度,故两个钛离子间最短距离为![]() apm。
apm。

 阅读快车系列答案
阅读快车系列答案【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
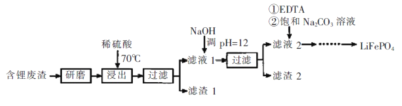
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
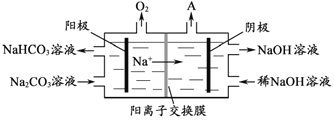
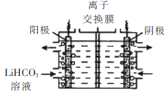
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。