题目内容
17克NH3共有 mol电子,0.1molH2S共有约 个分子,
同温同压下,同体积的NH3和H2S气体的质量比为 ;
同温同压下,同质量的NH3和H2S气体的体积比为 ;
同质量的NH3和H2S中氢原子的个数比为 。
10 6.02×1022 1:2 2:1 3:1
解析试题分析:n(NH3)=m/M=17g÷17g/mol=1mol。N(电子)=10×1mol=10mol。因为:n=N/NA所以N=" n" NA=0.1×6.02×1023= 6.02×1022。同温同压下,同体积的任何气体具有相同的体积。它们的物质的量也相等。这时同体积的氨气与硫化氢的质量比等于它们的摩尔质量之比。即为17:34="1:2." 同温同压下,同质量的NH3和H2S气体的体积比为(m÷17g/mol):(m)÷34g/mol)="2:1." 同质量的NH3和H2S中氢原子的个数比为(2×3):(1×2)=3:1.
考点:考查物质的量与质量、体积摩尔质量的关系及微粒与构成它的原子的关系等知识。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为 g 。
(3)下列操作,会引起所配溶液浓度偏高的是( )
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
F、定容时俯视刻度线
G、定容摇匀后,发现液面低于刻度线,再加至刻度线
(4)取所配Na2CO3溶液20ml,向其中滴加足量的稀盐酸,可得到标况下的气体 L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体 g。
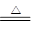 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算: 
 和
和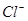 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。