题目内容
向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中 和
和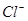 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
解:设混酸中含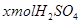 ,y mol HCl;与
,y mol HCl;与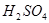 反应的
反应的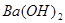 为z mol。
为z mol。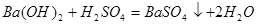
1mol 1mol 1mol
z x 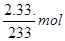 解得:x=0.01mol, z=0.01mol
解得:x=0.01mol, z=0.01mol
则 的物质的量浓度
的物质的量浓度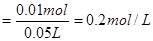
与HCl反应的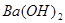 物质的量为:
物质的量为: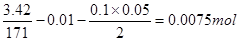
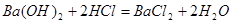
1mol 2mol
0.0075mol y
解得:y=0.015mol则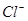 的物质的量浓度
的物质的量浓度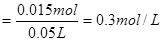 答:……
答:……
解析试题分析:得到干燥的沉淀物为BaSO4,根据BaSO4的量可以求出H2SO4的物质的量,进而求出SO42?的浓度,然后用Ba(OH)2的总量减去剩余的Ba(OH)2和与H2SO4的Ba(OH)2,可得与HCl反应的Ba(OH)2的量,从而求出Cl?的浓度。
考点:本题考查根据化学方程式的计算。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目

 2O3
2O3