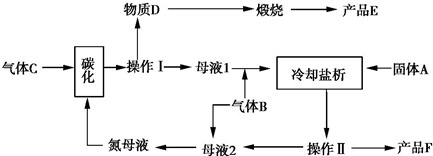
��Ŀ����
11��ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�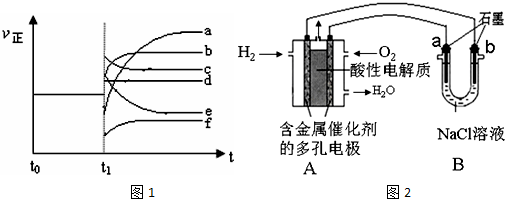
C��s��+H2O��g��?CO ��g��+H2 ��g����H=+131.3kJ•mol-1
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶���������С�����䣩��
��2��������Ӧ�ﵽƽ�������H2O��g����������C��s�������ʵ�����С������С�����䣩��
��3������˵��һ�����ж����Ϸ�Ӧ��ƽ�����BD
A������1mol H2O��g��ͬʱ����1mol H2
B�������ڻ�����������������
C��H2O��g����CO ��g����H2 ��g�����������Ũ�ȱ�Ϊ1��1��1
D�����º���ʱ�����������ѹǿ����
��4��������Ӧ��t0ʱ�̴ﵽƽ�⣬��t1ʱ�̸ı�ijһ����������Ӧ���ʣ���������ʱ��ı仯��ͼ1��ʾ��
�����Ӧ�ı�ţ�
�����������b��
�ڽ����¶�f��
��5��һ���¶��£����������о�������������Ӧ����������̿�������������ʵ����ʵ���Ũ�ȼ����淴Ӧ���ʹ�ϵ���±���ʾ������д���Т٢���Ӧ�Ŀո�
| ������� | c��H2O��/mol•L-1 | c��CO��/mol•L-1 | c��H2��/mol•L-1 | �����������Ƚ� |
| I | 0.06 | 0.60 | 0.10 | ����=���� |
| �� | 0.12 | 0.20 | ��0.6 | ����=���� |
| �� | 0.10 | 0.20 | 0.40 | �ڦ��������� |
�ٵ�����Һ��pH=14����������������������Һ��Ӧ��
�������������������ڱ�״������3.36 L��
���� ��1������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������
��2������H2O��g����������ѧƽ��������Ӧ�����ƶ���
��3�����淴Ӧ����ƽ��ʱ��ͬһ���ʱ�ʾ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��������䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯��˵������ƽ�⣻
��4������С���������ѹǿ����˲�����淴Ӧ���ʶ�����ƽ�����淴Ӧ�����ƶ����淴Ӧ����������࣬�������Ӧ����������ƽ�⣻
�ڽ����¶ȣ�˲�����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�������Ӧ���ʼ�С���࣬�������Ӧ����������ƽ�⣬������ƽ��ʱ������С��ԭƽ������ʣ�
��5�����ݢ����ƽ�ⳣ�������д���ƽ��״̬������ƽ�ⳣ���������c��H2����
������д�ʱ��Ũ����Qc����ƽ�ⳣ���Ƚϣ��жϷ�Ӧ���еķ��ݴ��жϣ�
��6����ⷢ����Ӧ��2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+Cl2��+H2����NaCl�����ʵ���Ϊ0.2L��1mol/L=0.2mol���Ȼ�����ȫ��Ӧ��������Ϊ0.1mol����ʵ����������Ϊ$\frac{4.48L}{22.4L/mol}$=0.2mol���ʻ�������Ӧ��2H2O$\frac{\underline{\;���\;}}{\;}$O2��+2H2����
�ٸ����Ȼ��Ƶ����ʵ�������Ϸ���ʽ��������NaOH�����ʵ���������������Һ�����������ӵ�Ũ�ȣ��ټ�����Һ��������Ũ�ȣ�����pH=-lgc��H+�����㣻
�������õ����������������������Ȼ��Ƶ����ʵ����������������ʵ����������������������������������ʵ������������������������
��� �⣺��1���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������
�ʴ�Ϊ������
��2������H2O��g����������ѧƽ��������Ӧ�����ƶ���̼�����ʵ�����С��
�ʴ�Ϊ����С��
��3��A������1mol H2O��g��ͬʱ����1mol H2������ʾ����Ӧ���ʣ���Ӧʼ�հ��˹�ϵ���У���A����
B��̼Ϊ���壬��������Ϊ���壬�淴Ӧ���л���������������������ڻ�����������������˵������ƽ�⣬��B��ȷ��
C��ƽ��ʱ�����Ũ��֮����ˮ��ת�����йأ���ˮ��ת���ʲ�һ��Ϊ50%����C����
D�����º���ʱ���淴Ӧ���л���������ʵ�������������ѹǿ���������������ѹǿ����ʱ����Ӧ����ƽ�⣬��D��ȷ��
��ѡ��BD��
��4������С���������ѹǿ����˲�����淴Ӧ���ʶ�����ƽ�����淴Ӧ�����ƶ����淴Ӧ����������࣬�������Ӧ����������ƽ�⣬������b���ϣ��ʴ�Ϊ��b��
�ڽ����¶ȣ�˲�����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�������Ӧ���ʼ�С���࣬�������Ӧ����������ƽ�⣬������ƽ��ʱ������С��ԭƽ������ʣ�����f���ϣ��ʴ�Ϊ��f��
��5���ɢ��֪��ƽ�ⳣ��K=$\frac{0.1��0.6}{0.06}$=1�����д���ƽ��״̬������ƽ�ⳣ����֪����c��H2��=$\frac{K��c��{H}_{2}O��}{c��CO��}$=$\frac{1��0.12}{0.2}$mol/L=0.6mol/L��
���д�ʱ��Ũ����Qc=$\frac{0.4��0.2}{0.1}$=0.8��1���ʷ�Ӧ������Ӧ������У��ʦ�����������
�ʴ�Ϊ��0.6������
��6���ٵ�ⷢ����Ӧ��2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+Cl2��+H2����NaCl�����ʵ���Ϊ0.2L��1mol/L=0.2mol���Ȼ�����ȫ��Ӧ��������Ϊ0.1mol����ʵ����������Ϊ$\frac{4.48L}{22.4L/mol}$=0.2mol���ʻ�������Ӧ��2H2O$\frac{\underline{\;���\;}}{\;}$O2��+2H2�����ɷ���ʽ��֪������NaOHΪ0.2mol����c��OH-��=$\frac{0.2mol}{0.2L}$=1mol/L����Һ��c��H+��=10-14mol/L����ҺpH=-lg10-14=14��
�ʴ�Ϊ��14��
��������������Ϊ������������NaCl�����ʵ���Ϊ0.2mol��
2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+Cl2��+H2��
0.2mol 0.1mol 0.1mol
�ʵ����ˮ���ɵ�����Ϊ0.2mol-0.1mol=0.1mol��
2H2O$\frac{\underline{\;���\;}}{\;}$O2��+2H2��
0.05mol 0.1mol
��������������������0.1mol+0.05mol����22.4L/mol=3.36L��
�ʴ�Ϊ��3.36L��
���� ���⿼�黯ѧƽ�ⳣ��Ӱ�����ء�Ӧ�ü��йؼ��㡢��ѧƽ�⼰��Ӧ���ʵ�Ӱ�����ء���ѧƽ��״̬���жϡ��йص��ԭ���ļ���ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��6���м���Ϊ�״��㣬ѧ���������������������������Ƶ����ʵ������ؼ����жϵ����̷����ķ�Ӧ���Ѷ��еȣ�

 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�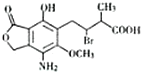 ij�л���M�Ľṹ��ʽ��ͼ��ʾ���������ʵ�����M��һ�������·ֱ�������ơ�����������Һ��̼��������Һ��Ӧ�������ĵ��ơ��������ơ�̼�����Ƶ����ʵ���֮��Ϊ��������
ij�л���M�Ľṹ��ʽ��ͼ��ʾ���������ʵ�����M��һ�������·ֱ�������ơ�����������Һ��̼��������Һ��Ӧ�������ĵ��ơ��������ơ�̼�����Ƶ����ʵ���֮��Ϊ��������| A�� | 1��1��1 | B�� | 2��4��1 | C�� | 1��2��1 | D�� | 1��2��2 |
| A�� | Fe��OH��3��������Fe��OH��3+3H+�TFe3++3H2O | |
| B�� | ��NaAlO2��Һ��ͨ�����CO2��Al��OH��3��2AlO2-+CO2+3H2O�T2Al��OH��3��+CO32- | |
| C�� | ��Ag���缫�����������Һ��4Ag++2H2O $\frac{\underline{\;ͨ��\;}}{\;}$ 4Ag+O2��+4H+ | |
| D�� | ��AgCl����Һ�м��뱥��NaI��Һ��Ӧ�����ӷ���ʽ��AgCl+I-�TAgI+Cl- |
| A�� | H2Y�ĵ��뷽��ʽΪ��H2Y+2H2O?2H3O++Y2- | |
| B�� | �ڸ���ʽ����Һ��c��Na+����c��Y2-����c��HY-����c��OH-����c��H+�� | |
| C�� | HY-��ˮ�ⷽ��ʽΪHY-+H2O?H3O++Y2- | |
| D�� | �ڸ���ʽ����Һ��c��Na+����c��HY-����c��OH-����c��H+�� |
| W | X | Y | Z | |
| �ṹ�� ���� | ����������Ӧ��ˮ����������̬�⻯�ﷴӦ�õ����ӻ����� | ��ɫ��Ӧ �ʻ�ɫ | ��ͬ��������Ԫ���γɵļ������У����Ӱ뾶��С���������������Ϊ���������� | ��������������֮��Ϊ�� |
��2��X�����������ĵ���ʽΪ
 ������Ӧ��ˮ������Y����������ﷴӦ�����ӷ���ʽΪAl2O3+2OH-=2AlO2-+H2O��
������Ӧ��ˮ������Y����������ﷴӦ�����ӷ���ʽΪAl2O3+2OH-=2AlO2-+H2O����3��W������������Ӧ��ˮ�������ڹ��ۻ����������ӡ����ۡ�����W��Z�γɵ���̬�⻯����ȶ��Դ�С��ϵ�ǣ�NH3��SiH4�����û�ѧʽ��ʾ��
W��һ���⻯��HW3�������л��ϳɣ���������������ƣ�����ΪһԪ���ᣩ�������Ũ�Ⱦ���ȵ�HW3��X������������Ӧ��ˮ�������Һ��ϣ���Ӧ�Ļ�ѧ����ʽ��HN3+NaOH=NaN3+H2O������ʽ�и������û�ѧʽ��ʾ��
��4��Y���ʺ�Mg��ɵĻ������һ�����ԭ�ϣ�ij��ȤС�����������ʾ��ʵ�鷽�����ⶨ�������Y��������������ȷ���������Y������������������abc������ţ���
a��m��n����b��m��y����c��n��y
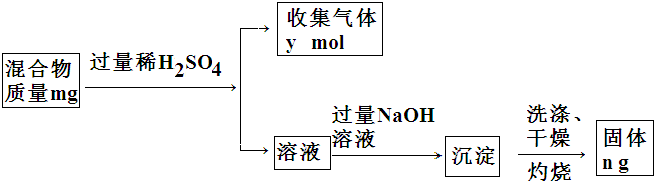
| A�� | Fe2+ | B�� | Fe3+ | C�� | Fe3+��Cu2+ | D�� | Fe2+ Cu2+ |
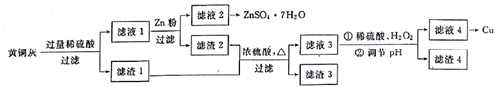
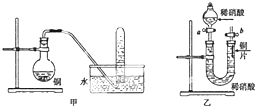 ��ͼ�Ǽס�����λͬѧ̽��ͭ��ϡ���ᣮ��Ӧ��ԭ�����ʵ��װ��ͼ����ش��������⣺
��ͼ�Ǽס�����λͬѧ̽��ͭ��ϡ���ᣮ��Ӧ��ԭ�����ʵ��װ��ͼ����ش��������⣺