题目内容
2.为了充分利用铜资源,某工厂拟用黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下: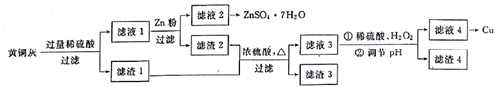
(1)滤渣1的主要成分为Cu和SiO2.稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+或Fe2O3+6H++Cu=2Fe2++Cu2++3H2O.
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是SO2,实验室通常用NaOH溶液吸收.
(3)稀硫酸通过浓硫酸稀释得到,稀释浓硫酸的正确操作方法是将浓硫酸沿着烧杯内壁缓缓加入蒸馏水中,同时不断地用玻璃棒搅拌. 过滤操作所需玻璃仪器除玻璃棒外还有烧杯、漏斗.
(4)用惰性电极电解滤液4可制取金属铜,若制得金属铜12.8g,则同时阳极得到L气体(标准状况).
分析 黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等),加入过量稀硫酸溶解Zn、CuO、ZnO、FeO、Fe2O3溶解,Cu、SiO2 不能溶解,过滤得到滤渣Ⅰ为Cu、SiO2 ,滤液为硫酸锌、硫酸铜、硫酸亚铁、硫酸铁,其中发生氧化还原反应的有锌和硫酸发生的反应,硫酸铁和铜发生的氧化还原反应,滤液Ⅰ加入锌粉还原铜离子和铁离子,亚铁离子,过滤得到滤液主要;硫酸锌溶液,浓缩冷却结晶得到硫酸锌晶体,滤渣2为铁和铜,滤渣1和滤渣2合并加入浓硫酸加热过滤得到滤渣3为二氧化硅,滤液3为硫酸铜、硫酸铁溶液,加入稀硫酸、过氧化氢氧化可能存在的亚铁离子为铁离子,调节溶液PH使铁离子沉淀过滤得到硫酸铜溶液和滤渣4为氢氧化铁沉淀,滤液4为硫酸铜溶液通过还原反应得到铜,
(1)上述分析可知滤渣1为二氧化硅和铜,稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应可能是铁离子和锌发生氧化还原反应;
(2)滤渣1及滤渣2中的铜和浓硫酸发生反应,用浓硫酸浸取会生成二氧化硫气体,二氧化硫是有毒气体不能排放到空气中,需要用氢氧化钠溶液吸收;
(3)浓硫酸溶于水会放热,密度比水大,稀释时需要把浓硫酸滴入水中且不断搅拌,过滤操作是分离固体和液体的基本操作,依据过程和装置所需要的仪器;
(4)依据电极反应和电子守恒计算得到阳极生成的气体体积.
解答 解:黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等),加入过量稀硫酸溶解Zn、CuO、ZnO、FeO、Fe2O3溶解,Cu、SiO2 不能溶解,过滤得到滤渣Ⅰ为Cu、SiO2 ,滤液为硫酸锌、硫酸铜、硫酸亚铁、硫酸铁,其中发生氧化还原反应的有锌和硫酸发生的反应,硫酸铁和铜发生的氧化还原反应,滤液Ⅰ加入锌粉还原铜离子和铁离子,亚铁离子,过滤得到滤液主要;硫酸锌溶液,浓缩冷却结晶得到硫酸锌晶体,滤渣2为铁和铜,滤渣1和滤渣2合并加入浓硫酸加热过滤得到滤渣3为二氧化硅,滤液3为硫酸铜、硫酸铁溶液,加入稀硫酸、过氧化氢氧化可能存在的亚铁离子为铁离子,调节溶液PH使铁离子沉淀过滤得到硫酸铜溶液和滤渣4为氢氧化铁沉淀,滤液4为硫酸铜溶液通过还原反应得到铜,
(1)上述分析可知滤渣1为Cu和SiO2,稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应可能是铁离子和锌发生氧化还原反应,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+或Fe2O3+6H++Cu=2Fe2++Cu2++3H2O,
故答案为:Cu和SiO2;2Fe3++Cu=2Fe2++Cu2+或Fe2O3+6H++Cu=2Fe2++Cu2++3H2O;
(2)滤渣1及滤渣2中的铜和浓硫酸发生反应,用浓硫酸浸取,浓硫酸被还原为二氧化硫气体,二氧化硫是有毒气体不能排放到空气中,需要用氢氧化钠溶液吸收,
故答案为:SO2;NaOH;
(3)浓硫酸溶于水会放热,密度比水大,稀释时需要把浓硫酸滴入水中且不断搅拌,稀释浓硫酸的步骤为:将浓硫酸沿着烧杯内壁缓缓加入蒸馏水中,同时不断地用玻璃棒搅拌,过滤操作是分离固体和液体的基本操作,依据过程和装置所需要的玻璃仪器为玻璃棒、烧杯、漏斗,
故答案为:将浓硫酸沿着烧杯内壁缓缓加入蒸馏水中,同时不断地用玻璃棒搅拌,玻璃棒、烧杯;
(4)用惰性电极电解滤液4可制取金属铜,阴极电极反应为:Cu2++2e-=Cu,若制得金属铜12.8g,物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,电子转移0.4mol,阳极电极反应为:4OH--4e-=2H2O+O2↑,得到氧气物质的量为0.1mol,则阳极得到气体标准状况下的体积为2.24L,
故答案为:2.24.
点评 本题考查了物质的分离提纯方法和过程分析判断,主要是物质性质和除杂试剂的理解应用,注意分析流程变化和试剂量的多少,掌握实验基本操作和物质性质是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | V(O2)=0.01mol/L•s | B. | V(NO)=0.008mol/L•s | ||
| C. | V(H2O)=0.003mol/L•min | D. | V(NH3)=0.002mol/L•s |
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
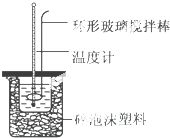 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据| 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8 kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大(填“偏大”、“偏小”或“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABE.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 处理废水时加入明矾作为消毒剂对水进行杀菌消毒 | |
| C. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| D. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| A. | C2H2 | B. | C2H6O | C. | C4H6 | D. | C2H4 |
C(s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C(s)的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BD
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
D.恒温恒容时容器内气体的压强不变
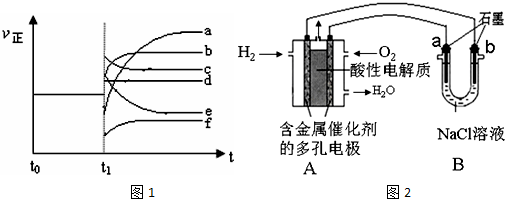
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如图1所示,
填出对应的编号.
①缩小容器体积b;
②降低温度f;
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ①0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ②ν正>ν逆 |
①电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
②阳极产生气体的体积在标准状况下是3.36 L.
①取代反应
②加成反应
③消去反应
④使溴水褪色
⑤使高锰酸钾酸性溶液褪色
⑥与AgNO3溶液生成白色沉淀
⑦加聚反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |