题目内容
6.下列离子方程式与所述事实相符且正确的是( )| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 用Ag作电极电解硝酸银溶液:4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$ 4Ag+O2↑+4H+ | |
| D. | 向AgCl悬浊液中加入饱和NaI溶液反应的离子方程式:AgCl+I-═AgI+Cl- |
分析 A.发生氧化还原反应生成碘化亚铁、碘、水;
B.反应生成氢氧化铝和碳酸氢钠;
C.用Ag作电极,阳极Ag失去电子,阴极银离子得到电子;
D.发生沉淀的转化.
解答 解:A.Fe(OH)3溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故A错误;
B.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B错误;
C.用Ag作电极电解硝酸银溶液,阳极为Ag-e-=Ag+,阴极为Ag++e-=Ag,故C错误;
D.向AgCl悬浊液中加入饱和NaI溶液反应的离子方程式为AgCl+I-═AgI+Cl-,故D正确;
故选D.
点评 本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应、电解反应及沉淀转化的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
17.从溴乙烷制取1.2-二溴乙烷,下列转化方案中最好的是( )
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
14.物质的量相同的下列有机物,充分燃烧耗氧量最大的是( )
| A. | C2H2 | B. | C2H6O | C. | C4H6 | D. | C2H4 |
1.化学与科学、技术、社会、环境密切相关.下列说法正确的是( )
| A. | 小苏打可以用作胃溃疡患者的胃酸中和剂 | |
| B. | 二氧化硫可以用来漂白纸浆、毛、丝、草帽辫、银耳、米粉等 | |
| C. | 飞机播撒碘化银或干冰可实现人工降雨 | |
| D. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸 |
11.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C(s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C(s)的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BD
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
D.恒温恒容时容器内气体的压强不变
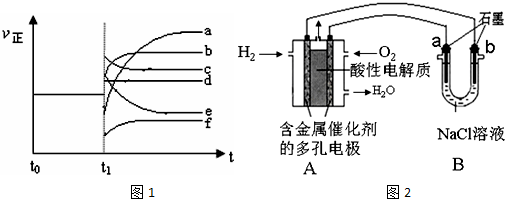
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如图1所示,
填出对应的编号.
①缩小容器体积b;
②降低温度f;
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
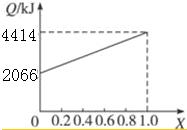
(6 )如图2是利用氢氧燃料作电源,用惰性电极电解200ml 1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气4.48L(设电解后溶液体积不变).
①电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
②阳极产生气体的体积在标准状况下是3.36 L.

C(s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C(s)的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BD
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
D.恒温恒容时容器内气体的压强不变
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如图1所示,
填出对应的编号.
①缩小容器体积b;
②降低温度f;
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ①0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ②ν正>ν逆 |
①电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
②阳极产生气体的体积在标准状况下是3.36 L.
18.某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种.已知常温下,A、B及CO、H2的燃烧热如下:
A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图.
(1)A、B的相对分子质量为A32,B114.
(2)等物质的量的A、B混合的燃料73 g,在160L O2中完全燃烧,反应后气体通过浓硫酸后,得到104L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定).由此可推得混合物中N(C):N(H):N(O)=9:22:1,A分子式为CH4O,B分子式为C8H18.
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980 kJ,则反应中生成CO0.5
mol.
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |

A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图.
(1)A、B的相对分子质量为A32,B114.
(2)等物质的量的A、B混合的燃料73 g,在160L O2中完全燃烧,反应后气体通过浓硫酸后,得到104L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定).由此可推得混合物中N(C):N(H):N(O)=9:22:1,A分子式为CH4O,B分子式为C8H18.
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980 kJ,则反应中生成CO0.5
mol.
16.下列物质属于苯的同系物是( )
| A. | 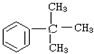 | B. |  | C. | 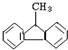 | D. | 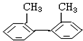 |
 .
. ,该化合物是由离子键形成.
,该化合物是由离子键形成.