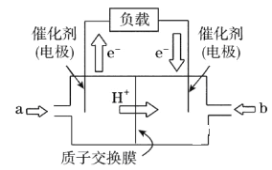
题目内容
【题目】常温下,用0.1molL-1的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示.AG=![]() ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱 B. A点溶液c(Cl)=c(R+)
C. 若b=10时,AG<0 D. 若b=15,溶液中存在c(Cl-)+c(OH-)=c(R+)+c(H+)
【答案】C
【解析】
A、根据0.1mol·L-1ROH的AG值计算;
B、A点溶液呈中性,依据电荷守恒判断;
C、b=10时,0.1molL-1的HCl溶液滴定10.00mL 0.1mol/LROH,恰好完全反应生成RCl,是强酸弱碱盐,溶液呈酸性,C(H +)/C(OH -)>0;
D、b=15,溶液中存在RCl两份,HCl一份,依据溶液中存在的电荷守恒判断。
A、0.1mol·L-1ROH的AG为-7.2,则:C(H +)/C(OH -)=10-7.2,结合C(H+)·C(OH-)=10-14,得C(OH-)=10-3.4mol·L-1,小于0.1mol·L-1,所以ROH为弱碱,故A正确;
B、依据溶液中电荷守恒原则:c(Cl-)+c(OH-)=c(R+)+c(H+),A点溶液呈中性,氢氧根离子浓度等于氢离子浓度,则c( Cl-)=c(R+),故B正确;
C、b=10时,0.1molL-1的HCl溶液滴定10.00mL 0.1mol/LROH,恰好完全反应生成RCl,是强酸弱碱盐,溶液呈酸性,C(H +)/C(OH -)>1,AG >0,故C错误;
D、b=15,溶液中存在RCl两份,HCl一份,依据溶液中存在的电荷守恒:c(Cl-)+c(OH-)=c(R+)+c(H+)故D正确;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目