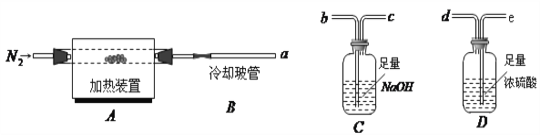
题目内容
【题目】现有浓度均为0.01mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。请回答下列问题:
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是_________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是_______(填序号)。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是_______。
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=______________;该温度下,将pH之和为13的NaOH溶液和醋酸溶液等体积混合后,所得溶液呈____(填“酸”“碱”或“中”)性。T℃时,将aL pH=11的NaOH溶液与bL pH=1的H2SO4溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
【答案】④>②>③>① ⑥>④>⑤>⑦ c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) 10-13 酸 9:2
【解析】
(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)从盐类的水解和弱电解质的电离程度角度分析;
(3)③和④等体积混合后,溶液溶质为NaCl和NH4Cl、NH3·H2O,从盐类的水解和弱电解质的电离程度角度分析;
(4)0.01mol·L-1NaOH溶液中c(OH-)=10-2mol·L-1,已知pH=11,根据Kw的公式计算;
pH之和为13的NaOH溶液和醋酸溶液,c(OH-)=c(H+),由于醋酸是弱酸,酸的浓度大于氢离子浓度;
根据c(H+)=n/V计算酸碱混合反应.
(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①;
(2)④氯化铵、⑤醋酸铵、⑥硫酸氢铵等溶液中存在:NH4++H2O![]() NH3·H2O+H+,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑦氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小,所以NH4+浓度由大到小的顺序是⑥④⑤⑦;
NH3·H2O+H+,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑦氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小,所以NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)③和④按体积比1:2混合后,溶液溶质为NaCl和NH4Cl、氨水,根据物料守恒知,c(Cl-)>c(NH4+),由于溶液中存在:NH3·H2O![]() NH4++OH-,一水合氨的电离程度大于氢根离子水解程度,则c(NH4+)>c(Na+),溶液呈碱性得c(OH-)>c(H+),故有:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) ;
NH4++OH-,一水合氨的电离程度大于氢根离子水解程度,则c(NH4+)>c(Na+),溶液呈碱性得c(OH-)>c(H+),故有:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) ;
(4)已知T℃时,0.01mol/L的氢氧化钠溶液的pH=11,该温度下,水的离子积Kw=0.01×10-11=1×10-13;
pH之和为13的NaOH溶液和醋酸溶液,氢氧化钠溶液中c(OH-)等于醋酸溶液中c(H+),由于醋酸是弱酸,酸的浓度大于氢离子浓度,所以混合后酸有剩余,则溶液显酸性;
在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则有:[0.1mol·L-1×bL-0.01mol·L-1×aL]/(a+b)L
=0.01mol·L-1,则a:b=9:2。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】化学反应原理知识在指导工业生产和环保等方面具有重要作用,请回答下列问题:
(1)已知热化学方程式:
①2C(s)+H2(g) = C2H2(g) △H1
②C(s)+O2(g) = CO2(g) △H2
③H2(g) +![]() O2(g) = H2O(l) △H3
O2(g) = H2O(l) △H3
则表示C2H2燃烧热的热化学方程式为____________________________。
(2)利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 40 |
压强/kPa | 20.0 | 19.5 | 18.3 | 16.0 | 16.0 | 16.0 | 22.0 |
①平衡时,SO2的转化率α= _________ %;
②T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
③下图分别代表焓变(△H)、混合气体平均相对分子(![]() )、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
)、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
A  B
B  C
C  D
D 
④40min时,改变的条件可能是_______________________________(写2点)。
(3)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结构如图所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量/mol | 0.025 | 0.5 | 9.475 | n |

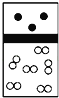
①二氧化碳的电子式为__________________。
②375℃时,测得排出的气体中含0.45molO2和0.0525molCO2,则Y的化学名称为______。