题目内容
【题目】ClO2是一种优良的消毒剂,常用于自来水的消毒,其沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。某学习小组在实验室通过反应30NaClO3 +20H2SO4(浓) +7CH3OH = 30ClO2↑+6HCOOH +10Na3H(SO4)2 + CO2↑+23H2O制备ClO2,并将其转化为便于运输和贮存的NaClO2固体,实验装置如下图所示。请回答下列问题:

(1)试剂X的名称为________________;盛放该试剂的仪器的名称为_____________。
(2)实验过程中需持续通入一定量的CO2,其目的是__________________;反应结束后需再通入一定量的CO2,其目的是_________________________。
(3)装置C中生成NaClO2的离子方程式为________________________________。
(4)设计实验证明NaClO2溶液具有氧化性:__________________________。(可供选的试剂:稀HNO3、稀H2SO4、K2SO3溶液、BaCl2、FeCl2溶液、KSCN溶液)
(5)上述装置存在一处明显的缺陷,其改进措施为_____________________________。
(6)某同学欲测定经ClO2消毒过的自来水中ClO2残留量,他进行了如下实验:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.向锥形瓶中加入20.00mL自然水;
Ⅲ.用0.1000mol·L-1 Na2S2O3溶液测定锥形瓶中生成I2的量(I2+2S2O32-=2I-+S4O62-),共用去amLNa2S2O3溶液。
①盛放Na2S2O3溶液的仪器为___________(填“酸式”或“碱式”)滴定管。
②水样中ClO2的含量为____________g/L。
【答案】浓硫酸 分液漏斗 使ClO2中混有一定量的CO2,防止ClO2浓度过高易发生爆炸 需将装置中残留的ClO2吹入装置C中参与反应,提高原料的利用率 2OH-+2ClO2+H2O2=2ClO2-+O2![]() +2H2O 向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性 接一个装有NaOH溶液的洗气瓶进行尾气处理 碱式 0.0675a
+2H2O 向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性 接一个装有NaOH溶液的洗气瓶进行尾气处理 碱式 0.0675a
【解析】
本题考查物质制备的知识。根据ClO2的制备原理和性质及装置图分析,A为制取CO2的装置,B为制取NaClO2装置,C为制取ClO2装置。根据ClO2浓度过大而发生爆炸的性质,选择A制取CO2通入降低ClO2的浓度,为了提高原料的利用率,需将装置中残留的ClO2吹入装置C中参与反应。因为ClO2有毒,要进行尾气处理。
(1)液体试剂混合时,应将密度大的液体加入到密度小的液体中,联系浓硫酸稀释时要做到“酸入水”,故试剂X的名称为浓硫酸;盛放浓硫酸的仪器为分液漏斗。答案:浓硫酸;分液漏斗。
(2) ClO2浓度较高时易发生爆炸,故实验过程中需持续通入一定量的CO2;反应结束后,为提高原料的利用率,需将装置中残留的ClO2吹入装置C中参与反应。答案:使ClO2中混有一定量的CO2,防止ClO2浓度过高易发生爆炸;需将装置中残留的ClO2吹入装置C中参与反应,提高原料的利用率。
(3)装置C中发生ClO2与H2O2在碱性条件下反应生成NaClO2和氧气,化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+O2![]() +2H2O,离子方程式为:2OH-+2ClO2+H2O2=2ClO2-+O2
+2H2O,离子方程式为:2OH-+2ClO2+H2O2=2ClO2-+O2![]() +2H2O;答案:2OH-+2ClO2+H2O2=2ClO2-+O2
+2H2O;答案:2OH-+2ClO2+H2O2=2ClO2-+O2![]() +2H2O;。
+2H2O;。
(4)向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性;答案:向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性;
(5)上述装置存在一处明显的缺陷是缺少尾气处理装置,其改进措施是在C后接一个装有NaOH溶液的洗气瓶,吸收未参与反应的ClO2;答案:接一个装有NaOH溶液的洗气瓶进行尾气处理。
(6)①因为Na2S2O3溶液显碱性,所以应用碱式滴定管装Na2S2O3溶液。答案:碱式。
②根据电子守恒确定关系式为10S2O32-![]() I2
I2![]() 2ClO2
2ClO2![]() 消耗0.1000mol·L-1 Na2S2O3溶液amL则消耗n(ClO2)=2a
消耗0.1000mol·L-1 Na2S2O3溶液amL则消耗n(ClO2)=2a![]() 10-5mol,水样中ClO2的含量为=(2a
10-5mol,水样中ClO2的含量为=(2a![]() 10-5mol
10-5mol ![]() 67.5g/mol
67.5g/mol![]() =6.75
=6.75![]() 10-2ag/L=0.0675ag/L。答案:0.0675a 。
10-2ag/L=0.0675ag/L。答案:0.0675a 。

 阅读快车系列答案
阅读快车系列答案【题目】化学反应原理知识在指导工业生产和环保等方面具有重要作用,请回答下列问题:
(1)已知热化学方程式:
①2C(s)+H2(g) = C2H2(g) △H1
②C(s)+O2(g) = CO2(g) △H2
③H2(g) +![]() O2(g) = H2O(l) △H3
O2(g) = H2O(l) △H3
则表示C2H2燃烧热的热化学方程式为____________________________。
(2)利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 40 |
压强/kPa | 20.0 | 19.5 | 18.3 | 16.0 | 16.0 | 16.0 | 22.0 |
①平衡时,SO2的转化率α= _________ %;
②T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
③下图分别代表焓变(△H)、混合气体平均相对分子(![]() )、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
)、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
A 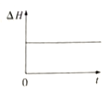 B
B 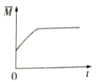 C
C  D
D 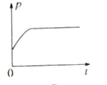
④40min时,改变的条件可能是_______________________________(写2点)。
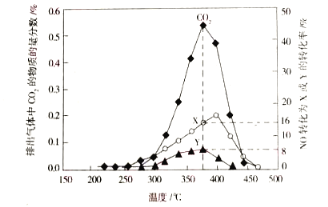
(3)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结构如图所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量/mol | 0.025 | 0.5 | 9.475 | n |
①二氧化碳的电子式为__________________。
②375℃时,测得排出的气体中含0.45molO2和0.0525molCO2,则Y的化学名称为______。





