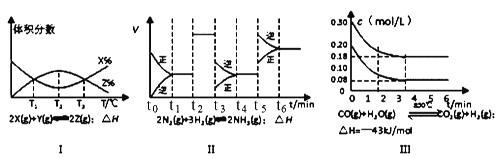题目内容
【题目】某学生用0.1mol/L HCl溶液滴定未知浓度的氢氧化钠溶液,
(1)写出下列仪器名称
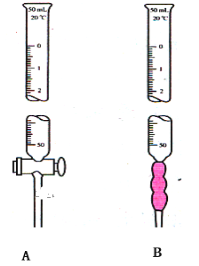
A________________。
B________________。
(2)操作可分解为如下几步:
①检查滴定管是否________________。
②用蒸馏水洗涤滴定管2~3次。
③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液________________2~3遍。
④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上________________处。
⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始_______________。
⑥取一定体积的待测液于锥形瓶中加入指示剂
⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度.
【答案】酸式滴定管 碱式滴定管 漏水 润洗 2-3cm 读数
【解析】
(1)根据滴定管的结构进行判断;
(2)根据滴定操作流程进行解答。
(1)有玻璃旋塞的为酸式滴定管,有一小段橡胶管的为碱式滴定管;所以A为酸式滴定管;B为碱式滴定管;
综上所述,本题答案是:酸式滴定管;碱式滴定管。
(2)①根据滴定操作可知,滴定管在使用前要检查滴定管是否漏水;②用蒸馏水洗涤滴定管2~3次,③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液润洗滴定管2~3遍,以所盛装的溶液被稀释;④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上2-3cm处;⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始读数;⑥取一定体积的待测液于锥形瓶中加入指示剂;⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度;
综上所述,本题答案是:漏水;润洗; 2-3cm; 读数。