题目内容
(12分)A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大,D、G同主族,A与B、C、D能形成电子数相同的二种常见分子,E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构。
(1)三种元素的名称。B ,D ,F 。
(2)A与 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
(3) A、D、E三种元素中的两种或三种形成的物质中,含有非极性键的离子化合物的电子式为: ;只含离子键的化合物的电子式为: 。
(4)E离子的半径 (填“大于” “小于”或“等于”)F离子的半径;E 和F元素最高价氧化物对应的水化物之间反应的离子方程式为: 。
(5)写出由上述各种元素形成的粒子中与BC—电子数相等的三种分子的化学式 、 。
(12分)
(1)B 碳 ,D 氧 ,F 铝 。(各1分)
(2)H2O2+H2S=S↓+2H2O (2分)
(3) 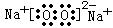 ;
; 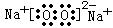 。(各1分)
。(各1分)
(4) 大于(1分) Al(OH)3+OH-=AlO2-+2H2O 。 (2分)
(6) N2 、 CO 。(各1分)
解析

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.