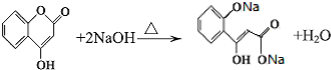
题目内容
1.一定温度下,将3mol PCl3和 1.5mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2?PCl5.各物质均为气态.达平衡后,PCl5为0.4mol.若此时再移走1.5mol PCl3 和0.75mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )| A. | 0.4mol | B. | 0.2mol | C. | 0.2mol<x<0.4mol | D. | <0.2mol |
分析 达平衡后移走1.5mol PCl3 和0.75mol Cl2,重新到达的平衡,可以等效为开始加入1.5mol PCl3 和0.75mol Cl2到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故平衡时PC15的物质的量小于原平衡的$\frac{1}{2}$倍.
解答 解:达平衡后移走1.5mol PCl3 和0.75mol Cl2,重新到达的平衡,可以等效为开始加入1.5mol PCl3 和0.75mol Cl2到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故平衡时PC15的物质的量小于原平衡的$\frac{1}{2}$倍,即达平衡时PC15的物质的量小于0.4mol×$\frac{1}{2}$=0.2mol,
故选D.
点评 本题考查化学平衡的移动、化学平衡的建立等,难度中等,关键是设计等效平衡建立的途径.

练习册系列答案
相关题目
6.取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下反应分别达到平衡,测得N2O4和HI的分解率分别为a(A)和a(B).在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为a′(A)和a′(B).下列判断一定正确的是( )
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |

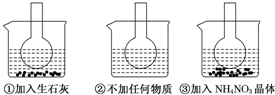
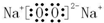 .
. ,请回答下列问题:
,请回答下列问题: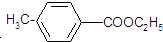 )是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
)是用于合成药物的中间体.请根据下列转化关系图回答有关问题: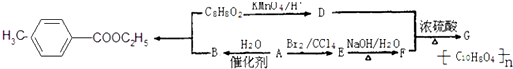
 .
.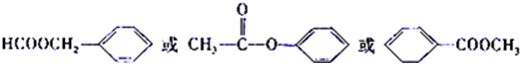 .
. )是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是ACD(填序号).
)是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是ACD(填序号).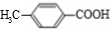 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$
 .
. ,
, .
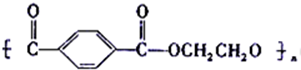
.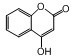 是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
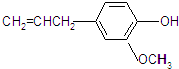
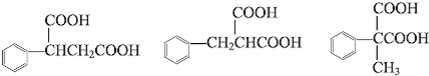 中的任意一种.
中的任意一种.