题目内容
10.下表为元素周期表的一部分,请参照下列元素在表中的位置,用化学用语回答下列问题:
(1)上述元素的最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式),其中含有的化学键类型是:离子键、共价键,c元素10电子的氢化物的结构式为
 .
.(2)写出e2d2的电子式为
 ,
,(3)用电子式表示bd2的形成过程
 .
.(4)由a单质和d的常见单质组成的燃料电池,其电解质溶液为KOH溶液,则正极反应式为:O2+2H2O+4e-═4OH-,工作一段时间后,电解质溶液的PH会减小(选填变大、变小、不变),若该电池每消耗2.24L a单质(标准状况)时,转移的电子数为1.204×1023.
(5)d的氢化物与i的氢化物的沸点较高的是H2O(填化学式),原因是H2O分子间存在氢键.
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为AB.
A.MnO2 B.FeCl3 C.Na2SO3 D.K2SO4
(7)已知由a、b形成的一种化合物,其相对分子质量在30~50之间,且b的质量分数为$\frac{6}{7}$.该化合物的分子式为C3H6.
分析 由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Al、g为Si、h为P、i为S、j为Cl.
(1)上述元素中Na的金属性最强,故NaOH碱性最强;c元素10电子的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(2)Na2O2由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,带2个单位负电荷;
(3)CO2属于共价化合物,分子中C原子与氧原子之间形成2对共用电子对,用C原子、O原子电子式表示其形成;
(4)氢气、氧气、KOH溶液构成燃料电池,正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,本质是氢气燃烧生成水,溶液中OH-离子浓度减小,碱性减弱;根据H元素化合价变化计算转移电子;
(5)水分子之间存在氢键,沸点高于硫化氢;
(6)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,硫酸钾不能催化H2O2分解;
(7)根据质量分数确定分子中C、H原子数目之比,进而确定最简式,再结合相对分子质量确定分子式.
解答 解:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Al、g为Si、h为P、i为S、j为Cl.
(1)上述元素中Na的金属性最强,故NaOH碱性最强,含有离子键、共价键;c元素10电子的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,结构式为 ,
,
故答案为:NaOH;离子键、共价键; ;
;
(2)Na2O2由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,带2个单位负电荷,电子式为: ,故答案为:
,故答案为: ;
;
(3)CO2属于共价化合物,分子中C原子与氧原子之间形成2对共用电子对,用C原子、O原子电子式表示其形成为: ,
,
故答案为: ;
;
(4)氢气、氧气、KOH溶液构成燃料电池,正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-═4OH-,本质是氢气燃烧生成水,溶液中OH-离子浓度减小,碱性减弱,溶液pH减小;氢气物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,故转移电子为0.1mol×2×6.02×1023mol-1=1.204×1023,
故答案为:O2+2H2O+4e-═4OH-;减小;1.204×1023;
(5)水分子之间存在氢键,而硫化氢分子之间为范德华力,氢键比范德华力更强,故水的沸点高于硫化氢,
故答案为:H2O;H2O分子间存在氢键;
(6)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,硫酸钾不能催化H2O2分解,
故答案为:AB;
(7)由C、H形成的一种化合物,其相对分子质量在30~50之间,且碳的质量分数为$\frac{6}{7}$,则化合物中C、H原子数目之比为$\frac{\frac{6}{7}}{12}$:$\frac{1-\frac{6}{7}}{1}$=1:2,最简式为CH2,令分子式为(CH2)x,则30<14x<50,故x=3,该化合物分子式为:C3H6,
故答案为:C3H6.
点评 本题考查元素周期表与元素周期律综合应用,是对学生综合能力的考查,学习中注意积累相关知识,注意用电子式表示化学键或物质的形成过程.

| A. | 0.4mol | B. | 0.2mol | C. | 0.2mol<x<0.4mol | D. | <0.2mol |
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少 | |
| B. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| C. | 第二周期元素从Li到F,非金属性逐渐减弱 | |
| D. | O与S为同主族元素,且O比S的非金属性弱 |
| A. | 镁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铁溶液中加入铜片:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯气通入水中:CI2+H2O═2H++CI-+CIO- | |
| D. | 硫酸溶液中加入氢氧化钡溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| 选项 | 实验目的 | 实验方案 |
| A | 验证Br2的氧化性强于l2 | 将少量溴水加入Kl溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| B | 探究石蜡油分解的产物含有烯烃 | 将石蜡油加强热产生的气体通入溴的四氧化碳溶液中 |
| C | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水溶加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| D | 验证Na能置换出醇烃基中的氢 | 向一定量的无水乙醇中加入足量Na,测量生成气体的体积 |
| A. | A | B. | B | C. | C | D. | D |
 氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越,安全性高、价格低廉、环保的储氢
氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越,安全性高、价格低廉、环保的储氢
 可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.
可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.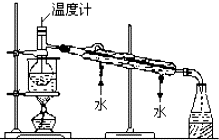 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题: