题目内容
【题目】在一定温度下,将 0.4 mol A(g)和 0.2 mol B (g)充入 10 L 的恒容密闭容器发生反应:2A(g)+B(g)xC(g)(x是化学计量数),达平衡时测得 C(g) 的浓度为 0.016mol/L,B(g)的物质的量为0.12mol。下列说法中不正确的是
A.x=2
B.达平衡时A的转化率为40%
C.该温度下该反应的化学平衡常数是K=12
D.反应前容器内的压强与平衡后容器内的压强之比为15:13
【答案】C
【解析】
利用题给数据可建立如下三段式:
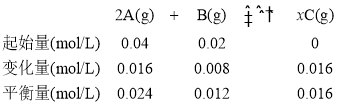
A.利用浓度的变化量之比等于化学计量数之比,可得出x=2,A正确;
B.达平衡时A的转化率为![]() =40%,B正确;
=40%,B正确;
C.该温度下该反应的化学平衡常数是K=![]() ≈37.04,C不正确;
≈37.04,C不正确;
D.反应前容器内的压强与平衡后容器内的压强之比为0.06mol/L: 0.052mol/L= 15:13,D正确;
故选C。

 阳光同学一线名师全优好卷系列答案
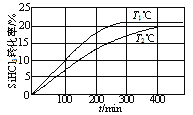
阳光同学一线名师全优好卷系列答案【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
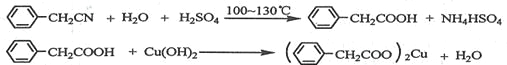
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是_____________________;仪器c的名称是______________,其作用是___________________________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是________________(填标号)。
A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是_____________,最终得到44 g纯品,则苯乙酸的产率是________。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________。
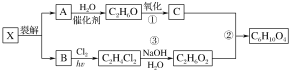
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
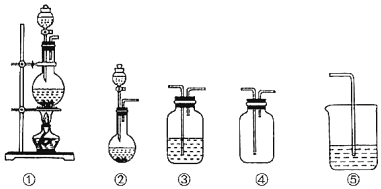
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③⑤ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A.AB.BC.CD.D
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4