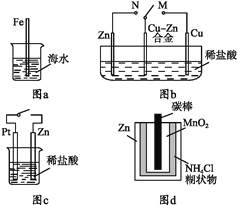
题目内容
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
【答案】B
【解析】试题分析:A.反应初始4s内A的平均反应速率v(A)=0.005mol/(Ls),速率之比等于化学计量数之比,所以v(B)=v(A)=0.005mol/(Ls),则4s内△c(B)=0.005molL-1s-1×4s=0.02mol/L,B的起始浓度为![]() =0.4mol/L,故4s时c(B)=0.4mol/L-0.02mol/L=0.38mol/L,故A正确;B.设平衡时A的浓度变化量为x,则:
=0.4mol/L,故4s时c(B)=0.4mol/L-0.02mol/L=0.38mol/L,故A正确;B.设平衡时A的浓度变化量为x,则:
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
开始(mol/L):0.1 0.4 0 0
变化(mol/L):x x x x
平衡(mol/L):0.1-x 0.4-x x x
故![]() =1,解得x=0.08,所以平衡时A的转化率为
=1,解得x=0.08,所以平衡时A的转化率为![]() ×100%=80%,故B错误;C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;D.1200℃时反应A(g)+B(g)C(g)+D(g)的平衡常数值为0.4,所以1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为
×100%=80%,故B错误;C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;D.1200℃时反应A(g)+B(g)C(g)+D(g)的平衡常数值为0.4,所以1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为![]() =2.5,故D错误;故选A。
=2.5,故D错误;故选A。

练习册系列答案
相关题目