题目内容
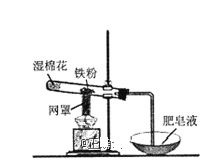
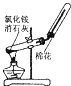
【题目】如图,将潮湿的Cl2通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂不可能是( )

A.饱和食盐水B.浓硫酸C.FeCl2溶液D.NaOH溶液
【答案】A
【解析】
将潮湿的Cl2通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色,说明甲装置装有能够吸收水或者能和氯气发生反应的物质。
A. 饱和食盐水与氯气不反应,同时抑制氯气的溶解,潮湿的氯气通过饱和食盐水后,成分并未改变,干燥红色布条会褪色,与题干要求不符,所以甲装置中所盛试剂不可能是饱和食盐水,故A正确;
B. 将潮湿的氯气通过浓硫酸时,浓硫酸有吸水性,导致氯气中不含水分,再通过放有干燥红色布条的乙装置,红色布条不褪色,符合题干要求,故B错误;
C. FeCl2具有还原性,氯气具有氧化性,氯气与FeCl2溶液反应生成FeCl3,将潮湿的氯气通过NaOH溶液后,再通过放有干燥红色布条的乙装置,红色布条不褪色,符合题干要求,故C错误;
D. 氯气为酸性气体,能和氢氧化钠反应,将潮湿的氯气通过NaOH溶液后,再通过放有干燥红色布条的乙装置,红色布条不褪色,符合题干要求,故D错误;
综上所述,正确答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】298K时,碳酸、醋酸和亚硫酸的电离平衡常数见下表:
名称 | 碳酸 | 醋酸 | 亚硫酸 |
电离常数(298K) | K1=4.4×10–7 K2=4.7×10–11 | K=1.8×10–5 | K1=1.3×10–2 K2=6.2×10–8 |
(1)298K时,碳酸、醋酸和亚硫酸,从强到弱的顺序_______________________.(用化学式表示)
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______________________。
(3)25℃时,相同浓度的CH3COONa溶液的碱性________Na2CO3溶液的碱性(填“>”“<”或“=”)。
(4)向醋酸溶液中加少量NaOH溶液,醋酸的电离平衡常数________(填“增大”、“减小”、“不变”).
(5)已知常温下:某NaHSO3溶液的pH=5,则该NaHSO3溶液中c(H2SO3) ________ c(SO32-)(填“>”“<”或“=”).
(6)25℃时,PH=4的亚硫酸溶液与PH=10的NaOH溶液等体积混合后,溶液显_________性.
A.酸性 B.碱性 C.中性 D.无法确定
【题目】在相同温度和体积下,对反应![]()
![]()
![]() 进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
物质的量 |
|
|
|
|
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,![]() 最大的是
最大的是![]()
A.甲B.乙C.丙D.丁