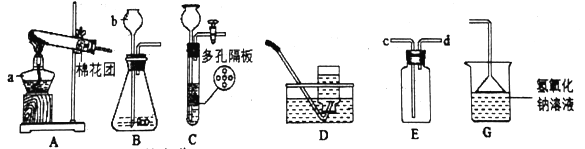
题目内容
【题目】马日夫盐(Mn(H2PO4)2)是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如下:
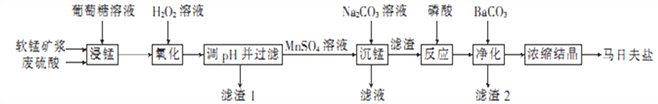
(1)粉碎软锰矿制成矿浆的目的是_________________________________________,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表所示、“调pH并过滤”时,应调整的pH范围为____________,滤渣1的主要成分为_________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐__________t。
【答案】 增大反应物接触面积,加快反应速率,提高原料利用率 12:1 2Fe2++H2O2+2H+![]() 2Fe3++2H2O 5.0~7.8 Fe(OH)3和Al(OH)3 MnCO3+2H3PO4
2Fe3++2H2O 5.0~7.8 Fe(OH)3和Al(OH)3 MnCO3+2H3PO4![]() Mn(H2PO4)2 +CO2↑+H2O 2.59(或2.5935)
Mn(H2PO4)2 +CO2↑+H2O 2.59(或2.5935)
【解析】(1)粉碎软锰矿制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率; 由葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O可知:葡萄糖做还原剂,MnO2做氧化剂;根据电子守恒:设MnO2为xmol, (C6H12O6)ymol,2x=y×(4-0)×6;x/y=12:1,正确答案:增大反应物接触面积,加快反应速率,提高原料利用率;12:1。
(2)反应中的亚铁离子在酸性条件下被双氧水氧化为铁离子,离子方程式为2Fe2++H2O2+2H+![]() 2Fe3++2H2O;正确答案:2Fe2++H2O2+2H+
2Fe3++2H2O;正确答案:2Fe2++H2O2+2H+![]() 2Fe3++2H2O。
2Fe3++2H2O。
(3)“调pH并过滤”时,主要除去铁离子和铝离子,变为沉淀而除去,根据表中数据可知应调整的pH范围为5.0--7.8,得到的沉淀(滤渣1)为Fe(OH)3和Al(OH)3 ;正确答案:5.0--7.8 ;Fe(OH)3和Al(OH)3。
(4)沉锰过程中形成碳酸锰沉淀,再加入磷酸,碳酸锰变为马日夫盐,反应的化学方程式为MnCO3+2H3PO4![]() Mn(H2PO4)2 +CO2↑+H2O ;正确答案:MnCO3+2H3PO4
Mn(H2PO4)2 +CO2↑+H2O ;正确答案:MnCO3+2H3PO4![]() Mn(H2PO4)2 +CO2↑+H2O。
Mn(H2PO4)2 +CO2↑+H2O。
(5)根据锰元素的量守恒规律:1t该软锰矿含有锰元素的量为:1×106×87%×(1-9%)÷87=0.0091×106mol, 马日夫盐Mn(H2PO4)2的量为0.0091×106mol,质量为0.0.0091×106×249=2.26×106g=2.26t;正确答案:2.26。

【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________________________。
(2)合成阿司匹林时,最合适的加热方法是______________________。

(3)提纯粗产品流程如下,加热回流装置如图:
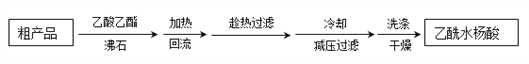
①沸石的作用是__________________________________;
②冷凝水的流出方向是________________(填“b”或“c”);
③使用温度计的目的是_____________________________________________________。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。