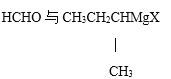题目内容
【题目】结合图示实验装置,回答下列问题。
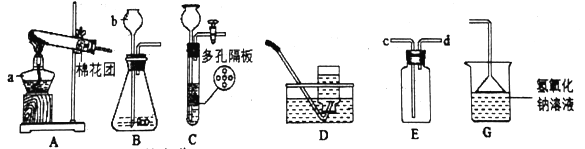
(1)图中b仪器的名称:______________。
(2)用高锰酸钾制取氧气,选用的发生装置是__________。实验室制取二氧化碳时,如需要E装置干燥二氧化碳,则E装置中应盛放__________,与B装置相比,若用C装置作为制取二氧化碳的发生装置,其优点为______________________________________。
【答案】长颈漏斗A浓硫酸便于控制反应的开始和停止
【解析】
(1)图中b仪器为滴加液体的玻璃仪器,其名称为长颈漏斗;因此本题答案是:长颈漏斗。
(2)高锰酸钾制氧气就需要加热,选用的发生装置是A;实验室制取二氧化碳时,常用碳酸钙和稀盐酸反应,二氧化碳气体中混有杂质氯化氢、水蒸气;因此E装置用来干燥二氧化碳气体,E装置中应盛放物质为浓硫酸;与B装置相比,C装置的优点是便于控制反应的开始和停止。综上所述,本题答案是:A,浓硫酸,便于控制反应的开始和停止。

【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A.用CCl4提取溴水中的Br2[来 | B.从KI和I2的固体混合物中回收I2 | C.吸收NH3(极易溶于水),并防止倒吸 | D.工业酒精制备无水酒精 |
|
|
|
|
A. A B. B C. C D. D
【题目】马日夫盐(Mn(H2PO4)2)是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如下:
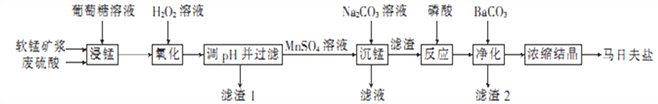
(1)粉碎软锰矿制成矿浆的目的是_________________________________________,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表所示、“调pH并过滤”时,应调整的pH范围为____________,滤渣1的主要成分为_________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐__________t。