题目内容
【题目】在酸性溶液中,下列离子不能大量存在的是
A. Mg2+ B. HCO3ˉ C. SO42﹣ D. Fe3+
【答案】B
【解析】
A、镁离子和氢离子不反应,所以能大量共存,故A不符合题意;
B、氢离子和碳酸氢根离子反应生成弱电解质水和非电解质二氧化碳,所以不能大量共存,故B符合题意;
C、氢离子和硫酸根离子不反应,所以能大量共存,故C不符合题意;
D、铁离子和氢离子不反应,所以能大量共存,故D不符合题意;
综上所述,本题正确答案为B。

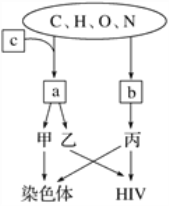
【题目】马日夫盐(Mn(H2PO4)2)是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如下:

(1)粉碎软锰矿制成矿浆的目的是_________________________________________,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表所示、“调pH并过滤”时,应调整的pH范围为____________,滤渣1的主要成分为_________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐__________t。
【题目】己知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×l0-39 | 1.7×l0-7 | 1.3×l0-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuC12·2H2O晶体,常加入CuO或Cu(OH)2,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuC12, 原因是(用化学方程式表示)_____________________________,由CuCl2·2H2O晶体得到纯净的无水CuCl2的合理方法是________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取1.44g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。将反应后的溶液稀释为100 mL,用0.1000mol/LNa2S2O3标准溶液(溶液呈弱碱性)进行滴定,滴定结果如下表所示。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.02 | 22.03 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.22 |
①可选用__________作滴定指示剂,滴定终点的现象是_________________________。
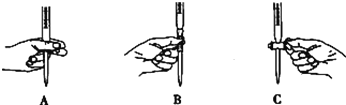
②滴定过程中操作滴定管的图示正确的是_____________。
③若滴定时出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶 b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.酸式滴定管滴至终点时俯视读数 d.酸式滴定管用蒸水洗后,未用标准液润洗
④CuCl2溶液与KI反应的离子方程式为______________________________。
⑤该试样中CuCl2·2H2O的质量百分数为____________________。