题目内容
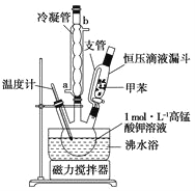
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
【答案】环形玻璃搅拌棒 D -51.8 kJ·mol-1 偏大 偏大 偏大 用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小
【解析】
(1)根据量热器的构造可知,仪器A为环形玻璃搅拌棒;综上所述,本题答案是:环形玻璃搅拌棒。
(2)A.为使反应充分,应用环形玻璃搅拌棒上下慢慢搅拌,不能用温度计搅拌,错误;
B.分多次加入氢氧化钠溶液,易造成热量损失,测定的中和热数值偏小,应该一次性快速加入,错误;
C.为减小实验误差,实验应该做2-3次,计算出平均值,只进行一次实验,就用所获得的数据计算中和热显然是不行的,错误;
D.用套在温度计上环形玻璃搅拌棒的轻轻地上下搅动,使溶液混合均匀,减小实验误差,正确;
综上所述,本题选D。
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为: 23.2℃,反应前后温度差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为: 23.4℃,反应前后温度差为: 3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为: 23.6℃,反应前后温度差为: 3.05℃;
50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液的质量和为m=100×1=100g,比热容c=4.18 J·g-1·℃-1;,代入公式Q=cmT得生成0.025mol的水放出热量Q=cmT=4.18×100×(3.15+3.1+3.05)/3=1.2959 kJ ;即生成0.025mol的水放出热量为:1.2959 kJ,所以生成1mol的水放出热量为1.2959×1/0.025=51.8 kJ;即该实验测得的中和热ΔH=-51.8 kJ·mol-1;综上所述,本题答案是:-51.8 kJ·mol-1。
(4)①量取稀盐酸时俯视量筒读数,所量取的盐酸体积偏小,盐酸总量减小,放出的热量会减小,测得的中和热ΔH会偏大;
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,酸碱发生中和,导致反应前后的温度变化量减小,放出的热量会减小,测得的中和热ΔH会偏大;
③用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小,测得的中和热ΔH会偏大;
综上所述,本题答案是:偏大,偏大,偏大;用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小。