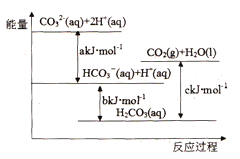
题目内容
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
【答案】C
【解析】
A.胶体不带电,胶粒带电荷,故A错误;
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取硫酸铜晶体的质量![]() 2.5g,故B错误;
2.5g,故B错误;
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,还是饱和溶液,所以溶液中Ca(OH)2的物质的量浓度不变,故C正确;
D. 制备氢氧化铁胶体时,当液体变为红褐色时应立即停止加热,如长时间煮沸会导致胶体聚沉,故D错误。答案选C。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往A、B两支试管中均加入4 mL 0.01 mol·L-1的酸性KMnO4溶液和2 mL 0.1 mol·L-1 H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tA________tB(填“>”“=”或“<”)。已知该反应的离子方程式:2MnO![]() +5H2C2O4+6H+===10CO2↑+2Mn2++8H2O
+5H2C2O4+6H+===10CO2↑+2Mn2++8H2O
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000 g乙二酸样品,配成250 mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.100 0 mol·L-1 KMnO4标准溶液装入______(填“酸式”或“碱式”)滴定管,进行滴定操作。
在滴定过程中发现,刚滴下少量KMnO4标准溶液时,溶液紫红色并没有马上褪去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪去,可能的原因是__________________________________________;判断滴定达到终点的现象是________________________________________________________________________。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4标准溶液的平均体积为________ mL,此样品的纯度为____________。
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
④误差下列操作会导致测定结果偏高的是________。
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
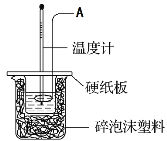
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
【题目】I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用![]() 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O82-)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是____________________________________________________________。
(2)显色时间t1为________。
(3)通过分析比较上述数据,得到的结论是___________________________________________________。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________。