题目内容
12.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如图: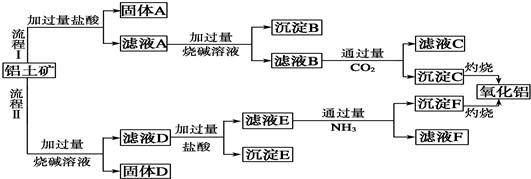
(1)给滤液E中通入过量的NH3,其反应的离子方程式是H++NH3•H2O=NH4++H2O、Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(2)流程Ⅱ中加入烧碱溶液后,生成SiO${\;}_{3}^{-}$的离子方程式是SiO2+2OH-═SiO32-+H2O.
(3)验证滤液A中含Fe3+,可取少量滤液并加入硫氰化钾(填写试剂名称).
(4)滤液C中溶质的主要成分是NaCl、NaHCO3(填化学式),写出该溶质的一种用途制纯碱(或作发酵粉、食用盐等).
(5)滤液C和滤液F共同的溶质为G,若用惰性电极电解500mL 0.1mol•L-1的G溶液,若阳极得到56mL气体(标准状况),则所得溶液在常温下的pH为12(忽略电解前后溶液体积的变化).
(6)已知25℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11.取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=1.8×10-9 mol•L-1.
分析 根据工艺流程Ⅰ可知,铝土矿与盐酸反应得固体A为滤液A,则固体A为SiO2,滤液A含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀B为氢氧化铁、氢氧化镁,滤液B含有偏铝酸钠、氯化钠,所以向滤液B中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀C为Al(OH)3,滤液C中含有NaCl、NaHCO3;
根据工艺流程Ⅱ可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体D为Fe2O3、MgO等,滤液D为硅酸钠、偏铝酸钠,滤液中通入过量盐酸,沉淀E为硅酸,滤液E中含有氯化铝、NaCl和过量的HCl,通入过量氨气,沉淀F为氢氧化铝,滤液F为氯化钠、氯化铵溶液,据此答题.
解答 解:根据工艺流程Ⅰ可知,铝土矿与盐酸反应得固体A为滤液A,则固体A为SiO2,滤液A含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀B为氢氧化铁、氢氧化镁,滤液B含有偏铝酸钠、氯化钠,所以向滤液B中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀C为Al(OH)3,滤液C中含有NaCl、NaHCO3;
根据工艺流程Ⅱ可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体D为Fe2O3、MgO等,滤液D为硅酸钠、偏铝酸钠,滤液中通入过量盐酸,沉淀E为硅酸,滤液E中含有氯化铝、NaCl和过量的HCl,通入过量氨气,沉淀F为氢氧化铝,滤液F为氯化钠、氯化铵溶液;
(1)根据以上分析,滤液E即氯化铝、NaCl和过量的HCl中通入过量的NH3,离子方程式为:H++NH3•H2O=NH4++H2O,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:H++NH3•H2O=NH4++H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(3)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:硫氰化钾;
(4)根据以上分析,滤液C中溶质的主要成分NaCl、NaHCO3,NaCl、NaHCO3一种用途为制纯碱(或作发酵粉、食用盐等),
故答案为:NaCl、NaHCO3;制纯碱(或作发酵粉、食用盐等);
(5)根据以上分析,滤液C和滤液F共同的溶质为G即氯化钠,用惰性电极电解氯化钠溶液,阳极上的电极反应式为:2Cl--2e-=Cl2↑,生成标准状况下56mL气体,即0.0025mol,转移电子数为0.005mol,所以阴极也有0.005mol的氢离子得电子生成氢气,所以生成氢氧根离子为0.005mol,c(0H-)=$\frac{0.005mol}{0.5L}$=0.01mol/L,则c(H+)=$\frac{Kw}{0.01}$=10-12mol/L,所以pH=12,
故答案为:12;
(6)已知25℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11,pH=13.00时溶液中的c(Mg2+)=$\frac{{K}_{sp}}{c(O{H}^{-})^{2}}$=$\frac{1.8×1{0}^{-11}}{0.{1}^{2}}$=1.8×10-9mol/L,
故答案为:1.8×10-9.
点评 本题以氧化铝提取工艺流程为载体,考查无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式、溶度积的计算等,难度中等.

 习题精选系列答案
习题精选系列答案| A. | Fe2O3•2SO3•7H2O | B. | 4Fe2O3•10SO3•25H2O | ||
| C. | 3Fe2O3•6SO3•20H2O | D. | 2Fe2O3•5SO3•17H2O |
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有离子键的化合物一定是离子化合物 |
 .
.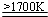 2AlN+3H2.
2AlN+3H2.
 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内最多
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内最多