题目内容
【题目】已知:pKa=lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L1NaOH溶液滴定20mL0.1mol·L1 H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法不正确的是( )
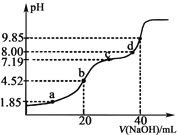
A. a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1mol·L1
B. b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. d点所得溶液中:c(Na+)>c(SO32-)> c(HSO3-)
【答案】A
【解析】A、H2SO3为弱酸,a点溶液中含硫的粒子有SO32-、HSO3 -、H2SO3 ,
,a点溶液体积大于20mL,根据物料守恒有c(H2SO3)+c(SO32-)+c(HSO3-)0.1 mol·L1,a点所加氢氧化钠溶液体积小于20ml,所以和H2SO3反应产物为NaHSO3和H2SO3,根据H2SO3的Ka1=c(HSO3-)×c(H+)/c(H2SO3),根据pKa1=lgKa1有Ka1=10-1.85=c(HSO3-)×10-1.85/c(H2SO3),所以c(HSO3-)=c(H2SO3),带入物料守恒式子中有:2c(H2SO3)+c(SO32-)0.1 mol·L1,A错误。B、b点加入氢氧化钠溶液的体积为20mL,与H2SO3恰好生成NaHSO3,根据物料守恒有:c(Na+)=c(SO32-)+ c(HSO3-)+ c(H2SO3),根据电荷守恒有:c(OH-)+2c(SO32-)+c(HSO3-)=c(Na+)+ c(H+),所以有:c(OH-)+2c(SO32-)+c(HSO3-)=c(SO32-)+ c(HSO3-)+ c(H2SO3)+c(H+),故c(H2SO3)+c(H+)=c(SO32-)+c(OH-),B正确。C、c点加入的氢氧化钠溶液大于20ml小于40ml,所以生成的溶质为Na2SO3和NaHSO3,根据c点溶液中H2SO3的第二步平衡常数,由pKa2=7.19可得Ka2=10-7.19,又根据Ka2=c(SO32-)×c(H+)/c(HSO3-),c(H+)=10-7.19,所以 c(SO32-)=c(HSO3-),又根据电荷守恒有c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以有c(Na+)=c(OH-)+3c(HSO3-)-c(H+),又因为c点呈碱性,c(OH-)>c(H+),所以c(Na+)>3c(HSO3-),C正确。D、d点恰好完全反应生成Na2SO3溶液,SO32-水解得到HSO3-,但是水解程度小,故有c(Na+)>c(SO32-)> c(HSO3-),D正确。故正确答案为A

 全优点练单元计划系列答案
全优点练单元计划系列答案