题目内容
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:①称取Wg草酸晶体配成100.0mL水溶液 ②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为amol/L KMnO4溶液滴定。滴定时,所发生的反应为:
2KMnO4 +5H2C2O4 +3H2SO4=K2SO4 +10CO2+2MnSO4 +8H2O 回答下列问题:
(1)实验①中,为配制准确物质的量浓度的草酸溶液,所需用到的仪器是天平(含砝码)、烧杯、药匙、胶头滴管和 _______、 __________ 。
(2)实验②中,滴定时,KMnO4溶液应装在_______式滴定管中(填“酸”或“碱”)
(3)若滴定用的KMnO4溶液因久置而部分变质,浓度偏低,则实验结果所测定的x值将_____(填“偏高”,“偏低”,“无影响”)。
(4)在滴定过程中起指示剂作用的是______,当KMnO4溶液与草酸反应后,怎样判断滴定终点____________________________________________________________________________.
(5)若达到滴定终点时,共用去amol/LKMnO4溶液VmL,则实验测得所配草酸溶液的物质的量浓度为_______;由此计算出草酸晶体中的x值是__________。(结果用a,v, W表示)
【答案】 玻璃棒 100mL容量瓶 酸式滴定管 偏低 KMnO4 溶液由无色变成淡紫色且半分钟之后不褪色 ![]() mol/L
mol/L 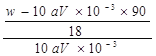 或者
或者![]()
【解析】(1)配制准确物质的量浓度的草酸溶液,所需用到的仪器是天平(含砝码)、烧杯、药匙、胶头滴管和玻璃棒、 100mL容量瓶。
(2) KMnO4溶液是强氧化剂,应装在酸式滴定管中。碱式滴定管上有橡胶管,易被氧化剂氧化。
(3)若滴定用的KMnO4溶液因久置而部分变质,浓度偏低,则滴定时消耗标准高锰酸钾溶液的体积将偏大,相当于样品中草酸的含量偏高,所以实验结果所测定的x值将偏低。
(4)因为反应物中KMnO4溶液是紫红色的,反应后生成的硫酸锰溶液接近无色,所以不用另加催化剂,在滴定过程中起指示剂作用的是KMnO4,溶液由无色变成淡紫色且半分钟之后不褪色时即达滴定终点.
(5)若达到滴定终点时,共用去amol/LKMnO4溶液VmL,则由两者反应的化学方程式可得,25mL草酸溶液中n(H2C2O4)= ![]() ,则实验测得所配草酸溶液的物质的量浓度为
,则实验测得所配草酸溶液的物质的量浓度为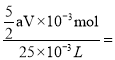
![]() mol/L.由此计算出Wg草酸晶体中n(H2C2O4)=
mol/L.由此计算出Wg草酸晶体中n(H2C2O4)= ![]() ,所以m(H2C2O4)=
,所以m(H2C2O4)= ![]() g/mol=0.9aV g,由草酸晶体的化学式得x:1=n(H2O): n(H2C2O4)=
g/mol=0.9aV g,由草酸晶体的化学式得x:1=n(H2O): n(H2C2O4)= ![]() :
:![]() ,化简得x=
,化简得x=![]() 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】工业制硫酸中,SO2的催化氧化是一个可逆反应:2SO2+O2 ![]() 2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
SO2 | O2 | SO3 | |
反应开始时的浓度(mol·L-1) | 3.0 | 1.5 | 0 |
10min后的浓度(mol·L-1) | |||
平均反应速率 (mol·L-1·min-1) | 0.1 |
___________、______________、________________、____________、_______________









