题目内容
20.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
分析 (1)SO2与过量NaOH溶液反应生成亚硫酸钠和水;
(2)利用刚吸收过少量SO2的NaOH溶液吸收含有氯气的尾气,根据溶液中发生的反应分析存在的阴离子;
①可假设1:只存在SO32-;假设2:既不存在SO32-,也不存在ClO-;假设3只存在ClO-;
②假设1:只存在SO32-,要证明SO32-的存在,应该选用氧化剂,结合已知试剂分析.
解答 解:(1)SO2与过量NaOH溶液反应生成亚硫酸钠和水,其反应的离子方程式为:SO2+2OH-=SO32-+H2O;
故答案为:SO2+2OH-=SO32-+H2O;
(2)利用刚吸收过少量SO2的NaOH溶液吸收含有氯气的尾气,少量的SO2与NaOH溶液反应生成Na2SO3,Na2SO3被氯气氧化生成硫酸钠,其反应方程式为Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O,故一定存在SO42-、Cl-,
故答案为:Cl-;SO42-;
(3)由已知可假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO-;假设3为:只存在ClO-;
故答案为:只存在ClO-;
②假设1:只存在SO32-,要证明SO32-的存在,应该选用氧化剂,
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液,若紫红色褪去,证明有SO32-,则说明假设1成立;
故答案为:
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
点评 本题属于实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.

练习册系列答案
相关题目
10.科学家预测原子序数为114的元素具有相当稳定的核素,它在元素周期表中的位置在第7周期ⅣA族,位于铅的下方,称为类铅.下列关于它的性质叙述中,错误的是( )
| A. | 它的最高价氧化物的水化物是强酸 | B. | 它的金属性比铅强 | ||
| C. | 它具有7个电子层 | D. | 它的最外层电子数为4 |
15.下列描述中正确的是( )
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
5.某化合物的性质如下:①加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体;②溶于水,加入硝酸钡溶液,产生能溶于稀硝酸的白色沉淀.则该物质是( )
| A. | NH4Cl | B. | (NH4)2CO3 | C. | NaCl | D. | K2SO4 |
12.氢氧燃料电池已用于航天飞机.该电池的构造示意图如图,有关说法错误的是( )

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
10.下列变化中,通过一步反应就可以直接完成的是( )
| A. | Al2O3→Al(OH)3 | B. | CaCO3→Ca(OH)2 | C. | CH3CH2OH→CH3CHO | D. | CO→Na2CO3 |



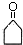 ,G中官能团的名称为酯基、碳碳双键.
,G中官能团的名称为酯基、碳碳双键. +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$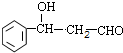 ,反应类型加成反应.
,反应类型加成反应. .
.