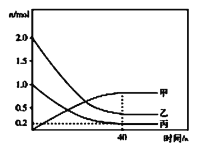
题目内容
【题目】向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为
A.3︰14B.1︰7C.2︰7D.3︰2
【答案】A
【解析】
向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,最后固体的质量与加入的铁粉的质量相等,则反应Fe+CuCl2=Cu+FeCl2导致固体增重等于反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量,
假定反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量为56g,物质的量为![]() =1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
=1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
Fe+CuCl2=Cu+FeCl2固体增重△m
1mol 64g-56g=8g
n(CuCl2) 56g
故n(CuCl2)=![]() ×1mol=7mol,
×1mol=7mol,
故原溶液中c(SO42-):c(Cl-)=1mol×3:7mol×2=3:14,
故选A。

练习册系列答案
相关题目