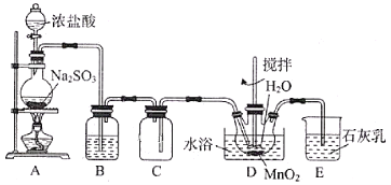
题目内容
【题目】根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g) ![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g) ![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ
C. 反应②的反应物总能量比反应①的反应物总能量低
D. 当反应②吸收52.96 kJ热量时转移2 mol电子
【答案】C
【解析】
I2(g)+H2(g)2HI(g)△H=-9.48kJmol-1;
②I2(s)+H2(g)2HI(g)△H=+26.48kJmol-1,
利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJmol-1-26.48kJmol-1=-35.96kJmol-1,根据二者转化的热化学方程式判断。
A. 254gI2(g)的物质的量为1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;
B. 由I2(g)=I2(s)△H=35.96kJmol1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误。
C. 由I2(g)=I2(s)△H=35.96kJmol1,可知I2(g)能量大于I2(s),则反应②的反应物总能量比反应①的反应物总能量低,故C正确;
D. 当反应②吸收52.96kJ热量时,反应了2mol氢气电子转移4mole,故D错误;
答案选C。

【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
容 器 | 容器类型 | 初始 体积 | 初始压 强/Pa | 反应物投入量/mol | 平衡时Cl2的 物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
Ⅰ | 恒温恒容 | 1 L | 2×105 | 4 | 1 | 0 | 0 | 1 |
Ⅱ | 绝热恒容 | 1 L | p2 | 0 | 0 | 2 | 2 | a |
Ⅲ | 恒温恒压 | 2 L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105 Pa, p3=4×105 Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行