题目内容
【题目】氮及其化合物与工农业生产及人们的日常生活密切相关。回答下列问题:
(1)利用某废铜下脚料(主要成分是![]() )可制备硫酸铜晶体(蓝矾),制备方法如图所示:
)可制备硫酸铜晶体(蓝矾),制备方法如图所示:
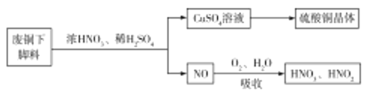
①蓝矾的化学式为:____________。
②废铜与浓硝酸,稀硫酸反应的化学方程式为______________。
(2)工业上制备尿素的反应是:![]() 。一定温度下,在容积为
。一定温度下,在容积为![]() 的恒溶液密闭容器中加入
的恒溶液密闭容器中加入![]() 和
和![]() ,反应过程中有关物质的物质的量(n)与时间的关系如图所示,
,反应过程中有关物质的物质的量(n)与时间的关系如图所示,![]() 是反应达到平衡状态。
是反应达到平衡状态。
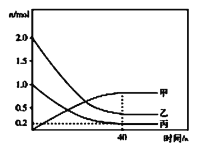
①曲线甲表示的物质是__________(写化学式)。反应开始至达到平衡时,平均反应速率![]() __________
__________![]() ,
,![]() 的平衡转化率是__________。
的平衡转化率是__________。
②升高温度,平衡__________(填“不移动”“向正反方向移动”或“向逆反应方向移动”,下同);及时从容器中分离出尿素,平衡__________。
(3)用![]() 电极作阳极可处理酸化后的亚硝酸盐污水,使
电极作阳极可处理酸化后的亚硝酸盐污水,使![]() 转化为无害气体,且溶液逐渐变为黄色,则
转化为无害气体,且溶液逐渐变为黄色,则![]() 转化为无害气体的离子方程式为__________。
转化为无害气体的离子方程式为__________。
【答案】![]()
![]()
![]() 或
或![]() 0.008
0.008 ![]() 向逆反应方向移动 不移动
向逆反应方向移动 不移动 ![]()
【解析】
(1)①蓝矾是五水合硫酸铜的俗称,据此书写化学式;②由流程图可知,![]() 与
与![]() 、
、![]() 反应只生成
反应只生成![]() ,没有生成
,没有生成![]() ,说明硝酸中的
,说明硝酸中的![]() 完全转化为
完全转化为![]() ,据此书写化学方程式;
,据此书写化学方程式;
(2)①根据曲线的特点结合化学计量数的关系分析判断曲线代表的物质,根据v=![]() 计算
计算![]() ,再结合三段式计算
,再结合三段式计算![]() 的平衡转化率;②该反应为放热反应,结合温度对平衡移动的影响分析判断平衡移动的方向;生成物
的平衡转化率;②该反应为放热反应,结合温度对平衡移动的影响分析判断平衡移动的方向;生成物![]() 为液体,结合浓度对平衡移动的影响分析判断平衡移动的方向;
为液体,结合浓度对平衡移动的影响分析判断平衡移动的方向;
(3)阳极为![]() ,失电子生成
,失电子生成![]() ,在酸性条件下能够将
,在酸性条件下能够将![]() 还原为无害的
还原为无害的![]() ,据此书写反应的离子方程式。
,据此书写反应的离子方程式。
(1)①蓝矾是五水合硫酸铜的俗称,其化学式为:CuSO45H2O,故答案为:CuSO45H2O;
②由流程图可知,![]() 与
与![]() 、
、![]() 反应只生成
反应只生成![]() ,没有生成
,没有生成![]() ,说明硝酸中的
,说明硝酸中的![]() 完全转化为
完全转化为![]() ,则化学方程式为
,则化学方程式为![]() =
=![]() ,故答案为:
,故答案为:![]() =
=![]() ;
;
(2)①曲线甲的特点是逐渐升高,则为生成物,而两种生成物的化学计量数相等,故甲为![]() 或
或![]() 。由图像中曲线的变化特点可知曲线丙为
。由图像中曲线的变化特点可知曲线丙为![]() ,则
,则![]() =
= =
=![]() 。
。

则![]() 的平衡转化率为
的平衡转化率为![]() ×100%=80%,故答案为:
×100%=80%,故答案为:![]() 或
或![]() ;0.008;80%;
;0.008;80%;
②由化学方程式![]() 可知,该反应为放热反应,升高温度,平衡向逆反应方向移动;生成物
可知,该反应为放热反应,升高温度,平衡向逆反应方向移动;生成物![]() 为液体,及时从容器中分离出尿素,不会导致平衡的移动,故答案为:向逆反应方向移动;不移动;
为液体,及时从容器中分离出尿素,不会导致平衡的移动,故答案为:向逆反应方向移动;不移动;
(3)阳极为![]() ,失电子生成
,失电子生成![]() ,该离子具有还原性,在酸性条件下能够将
,该离子具有还原性,在酸性条件下能够将![]() 还原为无害的
还原为无害的![]() ,反应的离子方程式为:
,反应的离子方程式为:![]() =
=![]() ,故答案为:
,故答案为:![]() =
=![]() 。
。