题目内容
8.如图是我国科技工作者研制的以尿素为原料生产三聚氰胺 (C3N6H6)的工艺--“常压气相一步法联产纯碱新技术”: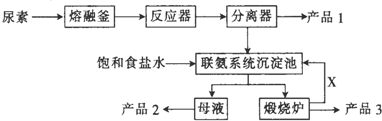
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水.
请回答下列问题:
(1)以尿素为原料生产三聚氰胺的原理是6CO(NH2)2 $\stackrel{一定条件下}{→}$1C3N6H6+6NH3↑+3CO2↑(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为坩埚.
(2)工业上合成尿素的化学方程式为CO2+2NH3→CO(NH2)2+H2O(反应条件可以不写).
(3)写出下列物质中主要成分的化学式:产品2NH4Cl、XCO2.
(4)联氨系统沉淀池中发生反应的化学方程式为CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓.
(5)为了使母液中析出更多的产品2,常用的方法是AD.
A.加入NaCl固体 B.加入NaHCO3固体
C.通入CO2 D.通入NH3
(6)若生产过程中有4%的尿素损耗,则1t尿素可生产0.336t三聚氰胺和0.848t副产品纯碱.(精确到0.001)
分析 (1)根据质量守恒定律进行配平,设尿素分子式前系数为m,三聚氰胺分子式前系数为n,氨气分子式前系数为x,二氧化碳分子式前系数为y,根据碳、氢、氧、氮原子守恒配平,实验室熔化尿素需要在坩埚中进行;
(2)工业上用二氧化碳和氨气反应来制取尿素,同时生成水;
(3)根据反应原理6CO(NH2)2 $\stackrel{一定条件下}{→}$C3N6H6+6NH3↑+3CO2↑,及生产流程分析产品2为氯化铵,X为二氧化碳;
(4)联氨系统沉淀池中,加入饱和食盐水和二氧化碳,大大降低了碳酸氢钠的溶度积,析出碳酸氢钠晶体;
(5)根据反应方程式CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓进行判断;
(6)设出三聚氰胺的质量、二氧化碳的物质的量,然后根据反应原理计算出三聚氰胺的质量,纯碱的质量.
解答 解:(1)根据质量守恒定律进行配平,设尿素分子式前系数为m,三聚氰胺分子式前系数为n,氨气分子式前系数为x,二氧化碳分子式前系数为y,根据碳、氢、氧、氮原子守恒得:①m=3n+y(C守恒),②4m=6n+3x(H守恒),③m=2y(O守恒),④2m=6n+x(N守恒)解得:m:n:x:y=6:1:6:3,所以方程式为:6CO(NH2)2 $\stackrel{一定条件下}{→}$C3N6H6+6NH3↑+3CO2↑,实验室熔化、灼烧固体物质需用坩埚,所以实验室熔化尿素需要在坩埚中进行,
故答案为:6、1、6、3;坩埚;
(2)工业上用二氧化碳和氨气反应来制取尿素,化学反应方程式为:CO2+2NH3→CO(NH2)2+H2O,
故答案为:CO2+2NH3→CO(NH2)2+H2O;
(3)根据生产流程,分离器中分离出产品1三聚氰胺;联氨系统沉淀池中加入饱和食盐水和二氧化碳,析出碳酸氢钠晶体,母液主要是氯化铵溶液,利用母液得到产品2氯化铵;X是能够循环利用的二氧化碳,
故答案为:NH4Cl;CO2;
(4)由于联氨系统沉淀池中,加入饱和食盐水和二氧化碳,大大降低了碳酸氢钠的溶度积,析出碳酸氢钠晶体,所以联氨系统沉淀池中发生的化学反应方程式为:
CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓;
(5)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓,可以向溶液中加入氯化钠或者通入二氧化碳气体,
故选A、D;
(6)设生成x吨三聚氰胺,同时生成nmol二氧化碳
根据反应6CO(NH2)2 $\stackrel{一定条件下}{→}$C3N6H6+6NH3↑+3CO2↑,
6×60 126 3mol
1t(1-4%) x n
$\frac{360x}{1t(1-4%)}$=126,解得x=0.336t,
n(CO2)=$\frac{1}{2}$×n[CO(NH2)2]=0.5×$\frac{1×1{0}^{3}(1-4%)}{60}$=8000mol,
由于氨气与二氧化碳的物质的量是2:1,反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3 中二氧化碳和氨气物质的量是1:1,氨气过量,所以应该按照二氧化碳的量计算生成纯碱的质量;根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3 及碳原子守恒,生成纯碱的物质的量就等于尿素反应生成的二氧化碳的物质的量,纯碱的质量为:106g/mol×8000mol=848000g=0.848t,
故答案为:0.336;0.848.
点评 本题考查了合成三聚氰胺的方法,涉及的知识点较多、综合性较强,考查同学们灵活运用所学知识进行分析问题、解决问题的能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | HCO3- 的电离程度大于HCO3-的水解程度 | |
| D. | 存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-等 |
| A. | 称取10.6gNaCO3,加入100mL容量瓶中,加水溶解,定容 | |
| B. | 称取10.6gNaCO3,加入100mL蒸馏水,搅拌,溶解 | |
| C. | 移液时未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,反复倒转,摇匀 |
(1)碱性;Sr(OH)2<Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的 观点解释其原因是同一主族元素,原子最外层电子数相同.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3.
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 4.7 |
②步骤Ⅱ中,能与盐酸反应而溶解的物质有SrCO3、BaCO3、FeO、Fe2O3、Al2O3.
③步骤Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全.
④下列关于该工艺流程的说法正确的是ac(填字母代号).
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率.
| A. | 银钵 | B. | 玉带 | C. | 字画 | D. | 铁牛 |
| A. | HR | B. | H2R | C. | RH4 | D. | RH3 |
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常温下白磷可自燃而N2须在放电时才与O2反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4 LO2含有的分子数目为NA | |
| C. | 1 molZn转变为Zn2+失去的电子数目为NA | |
| D. | 1 L 1mol•L-1KOH溶液中含有的钾离子数目为NA |
 某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.
某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.