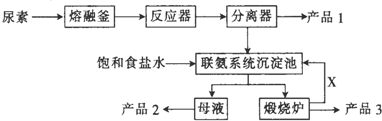
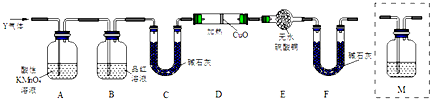
题目内容
6.配制100mL 1.0mol/L的NaCO3溶液,下列说法正确的是( )| A. | 称取10.6gNaCO3,加入100mL容量瓶中,加水溶解,定容 | |
| B. | 称取10.6gNaCO3,加入100mL蒸馏水,搅拌,溶解 | |
| C. | 移液时未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,反复倒转,摇匀 |
分析 A.容量瓶为精密仪器,不能溶解固体;
B.物质的量浓度中体积指溶液的体积;
C.依据容量瓶构造解答;
D.根据配制溶液的实验步骤来回答.
解答 解:A.容量瓶为精密仪器,不能溶解固体,故A错误;
B.称取10.6gNaCO3,加入100mL蒸馏水,溶液的体积大于100mL,溶液的浓度小于1.0mol/L,故B错误;
C.容量瓶瓶颈较细,移液操作时,防止液体外溅,需要玻璃棒来引流,故C错误;
D.定容后,塞好瓶塞,要进行摇匀操作,故D正确;
故选:D.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制过程及容量瓶的使用注意问题是解题关键,题目难度不大.

练习册系列答案
相关题目
16.如表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:
(1)③和⑧的氢化物沸点高的是HF(填化学式),原因是HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力更强.
(2)第三周期的元素形成的单原子离子半径最大的是P3-(填化学式).
(3)①和②按质量比3:8形成的化合物A的电子式为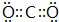 ,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)用电子式表示元素④与⑦的化合物的形成过程: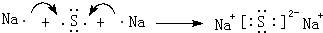 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)第三周期的元素形成的单原子离子半径最大的是P3-(填化学式).
(3)①和②按质量比3:8形成的化合物A的电子式为
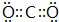 ,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.(4)用电子式表示元素④与⑦的化合物的形成过程:
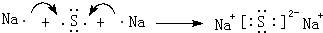 .
.
17.1995年化学家合成了一种分子式为C200H200的含多个碳碳三键的链状烃,其分子中碳碳三键最多可以是( )
| A. | 49个 | B. | 50个 | C. | 51个 | D. | 102个 |
14.下列物质中,属于“城市空气质量日报”报道的污染物是( )
| A. | N2 | B. | SO2 | C. | CO2 | D. | CO |
1.开发新材料是现代科技发展的方向,下列有关材料的说法不正确的是( )
| A. | 高温结构陶瓷是新型无机非金属材料 | |
| B. | 钢是用量最大、用途最广的合金,分为碳素钢和合金钢 | |
| C. | 硅芯片是各种计算机、微电子产品的核心材料 | |
| D. | 单晶硅常用于制造光导纤维 |
 某学生用0.1000mol•L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: