题目内容
【题目】下列既属于置换反应又属于放热反应的是
A.HCl+KOH=KCl+H2OB.4Na+O2=2Na2O
C.C+H2O![]() CO+H2D.2Mg+CO2
CO+H2D.2Mg+CO2![]() 2MgO+C
2MgO+C
【答案】D
【解析】
置换反应是单质与化合物反应产生新的单质和新的化合物的反应;常见的放热反应有:燃烧反应、金属与酸的反应、大多数化合反应、中和反应等,据此判断。
A.该反应是酸碱中和反应属于复分解反应,也属于放热反应,故A不合题意;
B.该反应属于化合反应,也属于放热反应,故B不合题意;
C.该反应是单质与化合物反应产生单质和化合物的反应属于置换反应,但该反应为吸热反应,故C不合题意;
D.该反应是单质与化合物反应产生单质和化合物的反应属于置换反应,同时属于燃烧反应,燃烧是放热反应,故D符合题意;
故选:D。

【题目】三氯氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂。实验室制取POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。采用氧气氧化液态PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
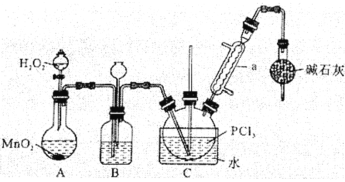
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体;遇水均剧烈水解为含氧酸和氯化氢;两者互溶。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为______。
(2)装置C中生成POCl3的化学方程式为__________。
(3)装置B的作用除观察O2的流速之外,还有_________、________。
(4)反应温度应控制在60-65℃之间,原因是__________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①实验Ⅰ结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725gPOCl3,产品,置于盛60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol·L-1AgNO3溶液,使氯离子完全沉淀;向其中加入少量硝基苯并用力摇动。
③以硫酸铁溶液为指示剂,用0.2 mol·L-1KSCN溶液滴定过量的AgNO3溶液,达滴定终点时共用去10.00mLKSCN溶液。
己知:Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN)。
(5)达滴定终点时的现象为____________。
(6)实验过程中加入硝基苯的目的是__________;若无此操作,则所测POCl3的含量将____________(填“偏高”、“偏低”或“不变”)。
(7)测得产品POCl3的百分含量为________(保留三位有效数字)。
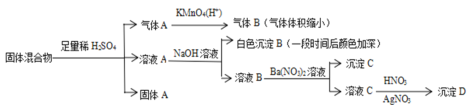
【题目】(1)某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 22.00 |
2 | 20.00 | 22.10 |
3 | 20.00 | 21.90 |
该未知盐酸的浓度为_____________(保留两位有效数字)
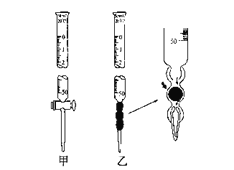
②滴定管如下图所示,用___________滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
③下列操作会使所测得的盐酸的浓度偏低的是______________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0 g样品溶解于适量水中,向其中加入含AgNO32.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
①判断滴定达到终点的现象是___________________。
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____________(选填“酸性”“中性”或“碱性”)为宜。
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。