题目内容
【题目】由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应。为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为aL。反应的化学方程式是__,样品中铝的质量分数是__(用含a的表达式表示)。
(2)若取同质量的样品,在高温下使其恰好反应,则a=__L;该反应的化学方程式是__。
【答案】2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ![]() 或0.075a 3.36 2Al+Fe2O3
或0.075a 3.36 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】
(1)铝与氢氧化钠反应生成偏铝酸钠和氢气,根据氢气的物质的量计算铝的质量分数;
(2)高温下恰好发生反应2Al+Fe2O3![]() 2Fe+Al2O3,则Al、Fe2O3的物质的量比为2:1。
2Fe+Al2O3,则Al、Fe2O3的物质的量比为2:1。
(1) 铝与氢氧化钠反应生成偏铝酸钠和氢气,铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
n(H2)=![]() =
=![]() mol,
mol,
设铝的物质的量是n
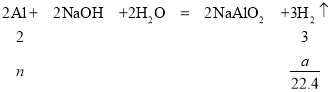
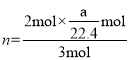 =
=![]() ,
,
m(Al)=27g·mol-1×![]() =
=![]() g,
g,
ω(Al)=![]() ×100%=0.075a。
×100%=0.075a。
(2)取同质量的样品,在高温下使其恰好反应,反应方程式为:2Al+Fe2O3![]() 2Fe+Al2O3,设混合物中含有xmol Al,ymol Fe2O3,
2Fe+Al2O3,设混合物中含有xmol Al,ymol Fe2O3,
则有:![]()
解之得:x=0.1,y=0.05,
根据铝和氢氧化钠溶液反应的化学方程式:![]() ↑,可知生成氢气的体积为a=
↑,可知生成氢气的体积为a=![]() =3.36L。
=3.36L。

 应用题作业本系列答案
应用题作业本系列答案【题目】1L恒容密闭容器中充入2molNO和1molCl2反应:2NO(g)+Cl2(g)![]() 2NOCl(g),在温度分别为T1、T2时测得NO的物质的量与时间的关系如表所示,正确的是
2NOCl(g),在温度分别为T1、T2时测得NO的物质的量与时间的关系如表所示,正确的是
t/min 温度/℃ | 0 | 5 | 8 | 13 |
T1 | 2 | 1.5 | 1.3 | 1.0 |
T2 | 2 | 1.15 | 1.0 | 1.0 |
A.T1>T2
B.T1时,反应前5min的平均速率为v(Cl2)=0.5mol·L-1·min-1
C.反应达平衡时,升高温度促进反应向正反应方向进行
D.T2时,向反应后的容器中充入2molNOCl(g),再次平衡时,c(NOCl)>2mol·L-1