题目内容
还原某二价金属的氧化物4克,需0.2mol电子,则该金属元素的相对原子质量为( )
| A.24 | B.40 | C.56 | D.64 |
A
解析试题分析::设金属元素为R,金属氧化物的物质的量为X。
RO→R转移电子
1mol 2mol
X 0.2mol ,X=0.1mol,金属氧化物的摩尔质量=4g/0.1mol=40g/mol,金属氧化物的相对分子质量为40,所以金属原子的相对原子质量为40-16=24,故选A.
考点:本题考查了氧化还原反应的有关计算,难度不大,能明确金属氧化物和转移电子的关系、摩尔质量和质量物质的量的关系、摩尔质量和相对分子质量的关系即可分析解答本题。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中含Cl-物质的量浓度最大的是( )
| A.5mL 0.1mol·L-1的氯化铝溶液 | B.10mL 0.1mol·L-1的氯化钙溶液 |
| C.30mL 0.2mol·L-1的氯化钾溶液 | D.40mL 0.25mol·L-1的氯化钠溶液 |
下列数值最接近阿伏伽德罗常数的是
| A.标准状况下22.4L乙醇中的分子数 | B.48g臭氧中的原子数 |
| C.常温常压下6mL水的原子数 | D.1 L l mol/L氨水中的离子数 |
在同温同压下,11.5 g气体A所占的体积和8 g O2所占的体积相同,则气体A的相对分子质量为( )
| A.46 | B.28 | C.44 | D.64 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1 mol硫酸钾中阴离子所带电荷数为NA |
| B.常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA |
| C.在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA |
| D.在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
与100mL0.1 mol·L—1AlCl3溶液中Cl—的物质的量浓度相等的是
| A.50mL0.1 mol·L—1NaCl溶液 | B.50mL0.15 mol·L—1MgCl2溶液 |
| C.10mL1.0 mol·L—1FeCl3溶液 | D.100mL0.3 mol·L—1KClO3溶液 |
下列化学用语正确的是
A.乙烯分子的电子式  |
B.硫原子的结构示意图 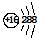 |
| C.淀粉的化学式 (C6H10O5)n |
| D.硫酸铁的电离方程式 Fe2(SO4)3 = 2Fe2+ + 3SO42ˉ |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1 L 0.1 mol·L-1的氨水含有0.1NA个OH- |
| C.常温常压下,22.4 L CCl4含有NA个CCl4分子 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |