题目内容
与100mL0.1 mol·L—1AlCl3溶液中Cl—的物质的量浓度相等的是
| A.50mL0.1 mol·L—1NaCl溶液 | B.50mL0.15 mol·L—1MgCl2溶液 |
| C.10mL1.0 mol·L—1FeCl3溶液 | D.100mL0.3 mol·L—1KClO3溶液 |
B
解析试题分析:100 mL 0.1 mol·L—1AlCl3溶液中Cl—的物质的量浓度为0.3 mol·L—1,与溶液的体积无关,A、0.1 mol·L—1NaCl溶液中Cl—的物质的量浓度为0.1 mol·L—1,错误;B、0.15 mol·L—1MgCl2溶液中Cl—的物质的量浓度为0.3 mol·L—1,正确;C、1.0 mol·L—1FeCl3溶液中Cl—的物质的量浓度3.0 mol·L—1错误;D、KClO3溶液电离的离子为K+、ClO3—,不存在Cl— ,错误。
考点:本题考查物质组成及微粒浓度的大小比较。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
还原某二价金属的氧化物4克,需0.2mol电子,则该金属元素的相对原子质量为( )
| A.24 | B.40 | C.56 | D.64 |
下列化学用语书写正确的是( )
| A.次氯酸的结构式:H—Cl—O |
B.丙烷分子的球棍模型示意图: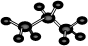 |
C.NH4H的电子式: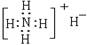 |
D.S2-的结构示意图: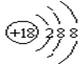 |
下列对化学用语的叙述正确的是
| A.碳原子最外层电子云有三种不同的伸展方向 |
B.CCl4的比例模型 |
| C.氮分子的结构式:N≡N: |
D.溴化铵的电子式: 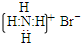 |
下列有关化学用语表示正确的是
A.氯化铵的电子式: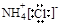 |
B.中子数为21的钾原子: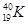 |
C.甲烷分子的球棍模型: |
D.HCO3-水解的离子方程式:HCO3-+H2O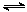 H2CO3+H3O+ H2CO3+H3O+ |
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.已知N2(g)+3H2(g)  2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 |
| B.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
| C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.2.9g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.01NA个 |
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
| A.16g | B.32g | C.64g /mol | D.32g /mol |
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是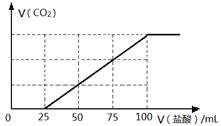
| A.原NaOH溶液的浓度为0.1 mol/L |
| B.通入CO2的体积为448 mL |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3) =" 1:" 3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3) =" 2:" 1 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )。
| A.1 mol Al3+含有的核外电子数为3NA |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.室温下,10 L pH=1的硫酸溶液中含有的H+数为2NA |
| D.室温下,10 L pH=13的NaOH溶液中含有的OH-数为NA |