题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1 L 0.1 mol·L-1的氨水含有0.1NA个OH- |
| C.常温常压下,22.4 L CCl4含有NA个CCl4分子 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
A
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.常温常压下,3.36L NO2和水反应转移的电子数为0.1NA |
| B.1 molNa2O2与足量的水反应,转移的电子数为2NA |
| C.在常温常压下,1molFe与1molCl2充分反应,转移的电子数约为3NA |
| D.在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O分子的总数小于1mol |
还原某二价金属的氧化物4克,需0.2mol电子,则该金属元素的相对原子质量为( )
| A.24 | B.40 | C.56 | D.64 |
设NA表示阿伏加德罗常数的数值,下列判断正确的是( )
| A.常温常压下,22.4 L CH4中含有的C—H键数为4NA |
| B.4.6 g由NO2和N2O4组成的混合气体中含有的氧原子数为0.3NA |
| C.含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D.1 mol Na在足量O2中燃烧生成Na2O2,钠失去的电子数为NA |
有硫酸镁溶液500 mL,它的密度是1.20 g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
| A.溶质的质量分数是24.0% |
| B.溶液的物质的量浓度是2.4 mol/L |
| C.溶质和溶剂的物质的量之比是1∶40 |
| D.硫酸根离子的质量分数是19.2% |
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含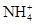 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=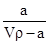 ×100% ×100% |
B.溶质的物质的量浓度c=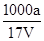 mol/L mol/L |
C.溶液中c(OH-)=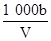 mol/L mol/L |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数可近似表示为( )
| A.22.4(m+n) |
| B.22.4×6.02×1023(m+n) |
| C.22.4(m+n)/(6.02×1023) |
| D.m+n |
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为 ( )。
| A.2∶7 | B.5∶4 | C.2∶1 | D.7∶2 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )。
| A.1 mol Al3+含有的核外电子数为3NA |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.室温下,10 L pH=1的硫酸溶液中含有的H+数为2NA |
| D.室温下,10 L pH=13的NaOH溶液中含有的OH-数为NA |