题目内容
10.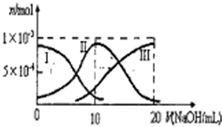 常温下,向10mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH:溶液.有关微粒的物质的量变化如图(其中I代表、H2A,Ⅱ代表ⅡAⅢ代表A2-).根据图示判断,下列说法不正确的是( )
常温下,向10mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH:溶液.有关微粒的物质的量变化如图(其中I代表、H2A,Ⅱ代表ⅡAⅢ代表A2-).根据图示判断,下列说法不正确的是( )| A. | 当V(NaOH)=10mL时,溶液中离子浓度的关系一有定:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 当V(NaOH)=15mL时,溶液中离子浓度的关系一定有:c(HA-)+2c(H+)+3c(H2A)=c(A2-)+2c(OH-) | |
| C. | 当V(NaOH)=15mL时,向溶液中滴加少量的盐酸或NaOH溶液,溶液的pH保持不变 | |
| D. | 当V(NaOH)=20mL时,向溶液中加水稀释,c(H+)减小,Kw不变 |
分析 A.根据图象知,当V(NaOH)=10 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
B.根据混合液中的物料守恒和电荷守恒判断;
C.当V(NaOH)=15mL时,形成了缓冲溶液;
D.当V(NaOH)=20mL时,反应溶质为Na2A,A2-部分水解溶液呈碱性,稀释后溶液中A2-的浓度减小,溶液中氢氧根离子浓度减小,则氢离子浓度增大.
解答 解:A.当V(NaOH)=10 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故A正确;
B.当V(NaOH)=15mL时,溶液中的溶质为相同物质的量的Na2A和NaHA的混合物,据物料守恒2c(Na+)=3c(HA-)+3c(H2A)+3c(A2-),据电荷守恒c(H+)+c(Na+)=2c(A2-)+c(OH-)+c(HA-),二者结合可得:c(HA-)+2c(H+)+3c(H2A)=c(A2-)+2c(OH-),故B正确;
C.当V(NaOH)=15mL时,溶液中的溶质为相同物质的量的Na2A和NaHA的混合物,形成了缓冲溶液,则向溶液中滴加少量的盐酸或NaOH溶液,溶液的pH基本保持不变,故C正确;
D.当V(NaOH)=20mL时,反应溶质为Na2A,溶液中A2-部分水解溶液呈碱性,加水稀释后溶液中A2-的浓度减小,则溶液中氢氧根离子浓度减小,而水的离子积不变,所以氢离子浓度增大,故D错误;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可.

| A. | 含氧酸的酸性:HClO3强于H2SO4 | |
| B. | Cl元素的最高正价比S元素的最高正价要高 | |
| C. | 气态氢化物溶于水后的酸性:HCl比H2S强 | |
| D. | Cl2能与H2S水溶液反应,生成S单质 |
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | C5H4 |
| A. | 还原剂是KClO3 | B. | HCl被还原 | ||
| C. | 得到3molCl2转移6mol电子 | D. | 氧化产物、还原产物都是Cl2 |
| A. | 1moLAl3+离子含有的电子数为3NA | |
| B. | 1moLCl2含有1NA个原子 | |
| C. | 78g过氧化钠固体中,含有1NA个阴离子 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L 水中 |
| A. | 食盐水 | B. | 泥水 | C. | Fe(OH)3胶体 | D. | 硫酸铜溶液 |
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
(2)最高价氧化物的水化物碱性最强的是氢氧化钠,酸性最强的是高氯酸,呈两性的是氢氧化铝;(本小题均填物质的名称)
(3)A、B、C、D、F、H、I形成的单质中,熔点最高的物质的化学式为C(金刚石);
(4)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).