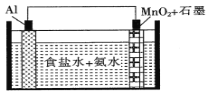
题目内容
【题目】下列离子方程式与所述事实相符且正确的是
A.铁粉与过量稀盐酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.用Ca(OH)2与NH4Cl固体混合共热制取少量氨气:OH-+NH4+![]() NH3↑+H2O
NH3↑+H2O
C.铝与NaOH溶液反应:Al+2OH-= AlO2-+ H2↑
D.NO2溶于水:3NO2+H2O![]() 2H++ 2NO3-+ NO
2H++ 2NO3-+ NO
【答案】D
【解析】
A.铁粉与过量稀盐酸反应的离子方程式为Fe+2H+![]() Fe2++H2↑,故A错误;
Fe2++H2↑,故A错误;
B.用Ca(OH)2与NH4Cl固体混合共热制取少量氨气时没有发生离子反应,故B错误;
C.铝与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-= 2AlO2-+3 H2↑,故C错误;
D.NO2溶于水生成硝酸和NO,发生的离子反应为3NO2+H2O![]() 2H++ 2NO3-+ NO,故D正确;
2H++ 2NO3-+ NO,故D正确;
故答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】近年来甲醇用途日益广泛,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭刚性的容器内,加入物质的量之比为![]() 的
的![]() 和
和![]() ,400℃时反应:
,400℃时反应:![]()
体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() _______________。
_______________。
(2)能说明该反应已达到平衡状态的是_______________。
a.![]() b.容器内压强保持不变
b.容器内压强保持不变
c.![]() d.容器内密度保持不变
d.容器内密度保持不变
(3)达到平衡时,甲醇在平衡体系中的体积分数为__________(保留小数点后一位)。
(4)![]() 与
与![]() 的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,
的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,![]() 应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
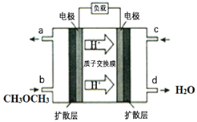
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH 1
CH3OCH3(g) + H2O(g) ΔH 1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5 kJ·mol-1、-1455.2 kJ·mol-1,且H2O(g) = H2O(l) ΔH=﹣44.0 kJ·mol﹣1。则反应i的ΔH 1=_________kJ·mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
催化剂 | 甲醇转化率/% | 二甲醚选择性/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
注:反应条件:常压、温度270℃,甲醇液体空速14mL/(g·h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
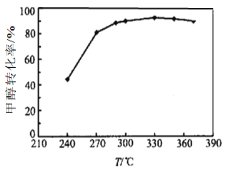
① 工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
② 某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质 | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
分压/MPa | 0.16 | 0.288 | 0.016 | … |
则反应i中,CH3OH(g)的平衡转化率α=_________。(用平衡分压代替平衡浓度计算;结果保留两位有效数字。)
II.二甲醚的应用:
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。该电池的负极反应式为:_________;