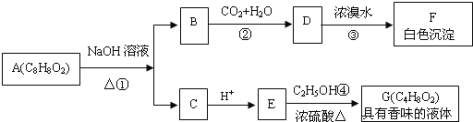
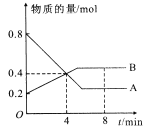
题目内容
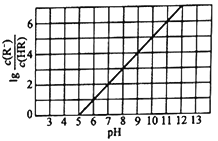
【题目】H2R为二元弱酸,向一定体积的0.1mol/L的H2R溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2R、HR-、R2-)的物质的量分数a(X)随pH的变化曲线如图所示[a(X)=c(X)/[c(H2R)+c(HR-)+c(R2-)]]。下列说法错误的是
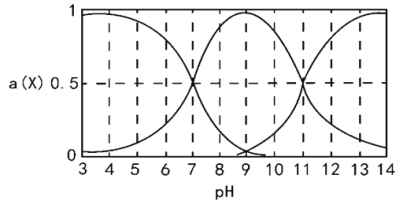
A. 常温下,K2(H2R)=1.0×10-11
B. 常温下,HR-在水中的电离程度大于其水解程度
C. pH=9时, c(Na+)>c(HR-)+2c(R2-)
D. pH=7时,c(H2R)=c(HR-)
【答案】B
【解析】
A、由图像知: pH=11时, c(R2-)= c(HR-),故K2(H2R) =![]() = 1.0×10-11,选项A正确;
= 1.0×10-11,选项A正确;
B、根据图像,pH =9时,溶液中的溶质主要是NaHR,此时溶液显碱性,故HR在水中的电离程度小于其水解程度,选项B错误;
C、pH =9时,根据电荷守恒,溶液中存在c(Na+)+ c(H+)=c(HR-)+2c(R2-)+ c(OH-),而c(H+)< c(OH ),故c(Na+)>c(HR-)+2c(R2- ),选项C正确;
D、由图中信息可知,pH=7时,c(H2R) = c(HR-),选项D正确。
答案选B。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率