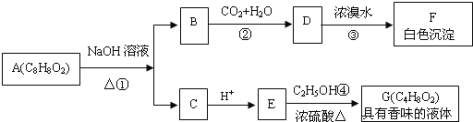
题目内容
【题目】(1)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。
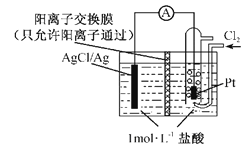
①正极反应为_________。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少______mol离子。
(2)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
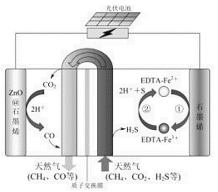
该装置工作时,阴极的电极反应:_________;协同转化总反应:___________;若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为_______性(碱性、中性、酸性)
(3)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池正极极增重______g。
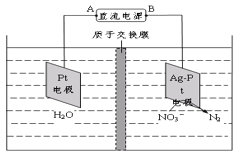
(4)电化学降解法可用于处理酸性硝酸盐污水,设计一电解池(如图所示)。 若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为____g。
【答案】Cl2+2e—=2Cl— 0.02 CO2+2H++2e-=CO+H2O CO2+H2S=CO+H2O+S 酸性 6.4 14.4
【解析】
(1)根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子生成AgCl,氯气在正极上得电子生成氯离子,电极反应式为Cl2+2e-═2Cl-;
(2) 根据示意图可知, ZnO@石墨烯作阴极,CO2被还原生成CO;石墨烯失电子作阳极,阳极Fe2+失电子生成Fe3+,Fe3+继续与H2S反应生成Fe2+与S,故协同转化总反应为CO2+H2S=
CO+H2O+S,且阳极的电势高;Fe2+、Fe3+易水解,只能在酸性条件下存在;
(3)电解Pb(NO3)2溶液制备PbO2时,阳极上铅离子失电子发生氧化反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+,蓄电池正极为PbO2,PbO2得电子发生还原反应生成电极反应式为PbO2+2e-+ +4H++SO42-= PbSO4+ 2H2O;
(4)根据图知,电解槽右边部分N元素化合价由+5价变为0价,所以硝酸根离子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O,阳极的电极反应式为2H2O-4e-═4H++O2↑。
(1)①根据电池总反应为2Ag+Cl2═2AgCl可知,氯气在正极上得电子生成氯离子,电极反应式为Cl2+2e-═2Cl-,故答案为:Cl2+2e-═2Cl-;
②放电时,当电路中转移0.01 mol e-时,交换膜左侧的电极放电产生0.01 mol Ag+,与电解质中的0.01 mol Cl-结合生成AgCl沉淀,同时约有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,则交换膜左侧溶液中约减少0.02 mol离子,故答案为:0.02;
(2)石墨烯失电子作阳极,ZnO@石墨烯作阴极,CO2被还原生成CO,电极反应式为CO2+2H++2e-=CO+H2O;石墨烯失电子作阳极,阳极Fe2+失电子生成Fe3+,Fe3+继续与H2S反应生成Fe2+与S,故协同转化总反应为CO2+H2S=CO+H2O+S,Fe2+、Fe3+易水解,只能在酸性条件下存在,故答案为:CO2+2H++2e-=CO+H2O;CO2+H2S=CO+H2O+S;酸性;
(3)电解Pb(NO3)2溶液制备PbO2时,阳极上铅离子失电子发生氧化反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+,23.9g PbO2的物质的量为0.1mol,反应转移的电子数目为0.2mol,蓄电池正极为PbO2,PbO2得电子发生还原反应生成电极反应式为PbO2+2e-+ +4H++SO42-= PbSO4+ 2H2O,由电极反应式可知,当PbO2得到2mol电子时,正极增重64g,则反应转移的电子数目为0.2mol,正极增重6.4g,故答案为:6.4;
(4)转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极的电极反应式为2NO3-+6H++10e-=N2↑+6OH-,转移2mol电子,阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,故答案为:14.4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
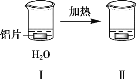
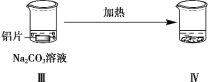
【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-