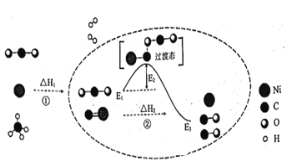
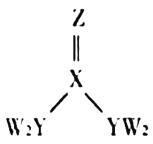题目内容
【题目】化学反应中的能量变化是人类获取能量的中重要途径
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是(______)
A.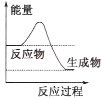 B.
B.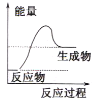 C.
C.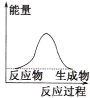
(2)"冰袋"可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间那部分,使两种晶体分开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量_____(填“高于”或“低于”)反应后生成物的总能量
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为______和_____;人们普遍使用的干电池工作时是将化学能转化为_____
(4)下列反应中,属于放热反应的是____,属于吸热反应的是_____。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧木炭取暖
③炸药爆炸 ④酸与碱的中和反应
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(5)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
【答案】A 低于 光能 热能 电能 ②③④⑤⑥ ① -484
【解析】
(1)液化气燃烧过程是放热反应,反应物总能量高于生成物的总能量,据此特征分析图象;
(2)依据反应前后能量守恒分析判断,温度降低,反应吸热,生成物总能量比反应物总能量高;
(3)依据变化过程中的特征和能量变化形式分析判断,化学能可以转化热能、电能、光能等形式的能量;
(4)常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2)、少数置换反应(如C和H2O)、碳、一氧化碳、氢气等还原金属氧化物;据此解答;
(5)根据焓变△H=反应物键能之和-生成物键能之和进行计算。
(1)液化气燃烧过程是放热反应,反应物总能量高于生成物的总能量,
A. 反应物总能量高于生成物总能量,反应是放热反应,符合液化气燃烧的能量变化关系,A项正确;
B. 反应物总能量低于生成物的总能量,反应是吸热反应,不符合液化气燃烧放热,B项错误;
C. 反应物总能量等于生成物的能量,不符合液化气燃烧放热,C项错误;
故答案为:A;
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,使袋内两种固体粉末充分混合,便立即产生低温,说明环境温度降低能量减小,依据反应前后能量守恒,两晶体的反应为吸热反应,则碳酸钠晶体与硝酸铵晶体的总能量低于反应后生成物的总能量;
故答案为:低于;
(3)根据物质变化过程中的特征和能量变化分析,化学能可以转化热能、电能、光能等形式的能量,点蜡烛来照明,这是将化学能转化为光能,同时释放热量,化学能转化为热能,人们普遍使用的干电池,利用的是原电池原理,是将化学能转化为电能;
故答案为:光能;热能;电能;
(4)①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)是分解反应,属于常见的吸热反应;
②燃烧木炭取暖是物质的燃烧,放出热量,属于常见的放热反应;
③炸药爆炸要放出热量,属于放热反应;
④酸与碱的中和反应要放热热量,属于常见的放热反应;
⑤生石灰与水作用制熟石灰,是化合反应,放出热量,属于常见的放热反应;
⑥食物因氧化而腐败要放热热量,属于放热反应;
故答案为:②③④⑤⑥;①;
(5)已知拆开1molH2中的化学键需要消耗436.4kJ能量,拆开1molO2中化学键需要消耗498kJ能量,形成水分子中1molHO键释放462.8kJ能量,
则2H2+O2=2H2O中△H=436.4kJ/mol×2+498kJ/mol462.8kJ/mol×4=480.4kJ/mol,
故答案为:-484

 计算高手系列答案
计算高手系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
a.HA + HC2-(少量) = A-+ H2C-
b.H2B(少量) + 2A- = B2- + 2HA
c.H2B(少量) + H2C- = HB-+ H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
②下列反应的离子方程式正确的是____________。
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
③完成下列反应的离子方程式:
a.H3C + OH-(过量)——__________________;b.HA(过量) + C3- ——_____________________。
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________.
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。