题目内容
【题目】有机物J是一种消炎镇痛药,下图为J的合成路线(部分产物和反应条件省略):

已知部分信息如下:
①![]() (此类物质易与水、酸等反应)
(此类物质易与水、酸等反应)
②![]()
回答下列问题:
(1)A中官能团的名称是_________,D + I→J的反应类型为___________。
(2)反应B→C的化学方程式为__________________。
(3)E→F的反应条件为___________,在质谱仪上E的最大质荷比为________。
(4)J有多种同分异构体,其中满足下列条件,且苯环上一氯代物只有两种的异构体的结构简式为________________。
a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应;c.能发生水解反应
(5)证明G已部分生成H的实验方案是__________________。
(6)参照上述流程,设计以 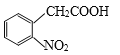 为原料,制备
为原料,制备 的合成路线(无机试剂任选)。_______________________________。
的合成路线(无机试剂任选)。_______________________________。
【答案】碳碳双键 取代反应 2CH3CHO +O2![]() 2CH3COOH FeBr3(Fe)作催化剂 78
2CH3COOH FeBr3(Fe)作催化剂 78 ![]() 取少量样品滴加FeCl3溶液,溶液变紫
取少量样品滴加FeCl3溶液,溶液变紫 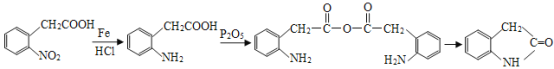
【解析】
根据A的分子式可知,A为乙烯,乙烯催化氧化生成B,B为乙醛;乙醛继续氧化生成C,C为乙酸;根据信息①,2分子乙酸反应生成D,D为乙酸酐(![]() );根据F为溴苯,E可能为苯;结合I的结构可知,溴苯发生硝化反应对位取代生成G,G为
);根据F为溴苯,E可能为苯;结合I的结构可知,溴苯发生硝化反应对位取代生成G,G为![]() ,G水解后酸化生成H。H为
,G水解后酸化生成H。H为![]() ;根据信息②,H中硝基被还原生成氨基;D与I发生取代反应生成J(
;根据信息②,H中硝基被还原生成氨基;D与I发生取代反应生成J(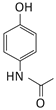 )。据此分析解答。
)。据此分析解答。
(1)A为乙烯,还原的官能团为碳碳双键,根据流程图中产物J的结构和D与I的结构可知,D + I→J的反应类型为取代反应,故答案为:碳碳双键;取代反应;
(2)反应B→C为乙醛催化氧化生成乙酸,反应的化学方程式为2CH3CHO +O2![]() 2CH3COOH,故答案为:2CH3CHO +O2
2CH3COOH,故答案为:2CH3CHO +O2![]() 2CH3COOH;
2CH3COOH;
(3)E→F为苯的溴代反应,反应条件为FeBr3(Fe)作催化剂,苯的相对分子质量为78 ,在质谱仪上E的最大质荷比为78,故答案为:FeBr3(Fe)作催化剂;78;
(4)J( )有多种同分异构体,a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应,说明含有醛基;c.能发生水解反应,说明含有酯基,结合J的分子式可知,该同分异构体为甲酸酯;且苯环上一氯代物只有两种,满足条件的同分异构体为
)有多种同分异构体,a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应,说明含有醛基;c.能发生水解反应,说明含有酯基,结合J的分子式可知,该同分异构体为甲酸酯;且苯环上一氯代物只有两种,满足条件的同分异构体为![]() ,故答案为:
,故答案为:![]() ;
;
(5)要证明G(![]() )已部分生成H(
)已部分生成H(![]() ),只需要证明有酚羟基生成,可以通过滴加FeCl3溶液,溶液变紫来验证,故答案为:取少量样品滴加FeCl3溶液,溶液变紫;
),只需要证明有酚羟基生成,可以通过滴加FeCl3溶液,溶液变紫来验证,故答案为:取少量样品滴加FeCl3溶液,溶液变紫;
(6)以 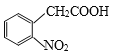 为原料,制备
为原料,制备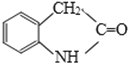 ,根据题干流程图中D和I反应生成J的提示,需要合成酸酐,并且将硝基转化为氨基,结合信息①②将
,根据题干流程图中D和I反应生成J的提示,需要合成酸酐,并且将硝基转化为氨基,结合信息①②将 中羧基转化为酸酐,硝基转化为氨基即可,因此合成路线为
中羧基转化为酸酐,硝基转化为氨基即可,因此合成路线为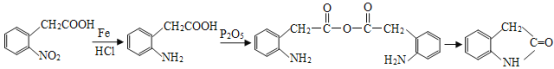 ,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2019/07/19/08/b412adcb/SYS201907190803093802717524_DA/SYS201907190803093802717524_DA.012.png" width="554" height="69" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。
,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2019/07/19/08/b412adcb/SYS201907190803093802717524_DA/SYS201907190803093802717524_DA.012.png" width="554" height="69" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是___________________,“沉渣2”的主要成分是_____,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________。
(2)用离子方程式解释加入NH4F “除Ca”的过程________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为_______。
(4)“操作X”是________、________
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为__________________。
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)= ____mol/L。
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。






