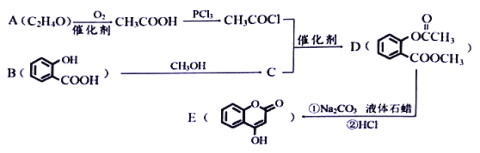
题目内容
【题目】利用氟磷灰石[主要成分Ca5(PO4)3F生产磷酸主要有热法和湿法两种方法。其流程如下:

热法:工业上将氟磷灰石、焦炭和石英砂(SiO2)混合后,在电炉中加热到1500℃生成白磷(P4)、SiF4、CO,白磷在空气中燃烧生成五氧化二磷,再经水化制成粗磷酸。
湿法:武汉化工研究院为技术攻关,实验室模拟生产磷酸的流程。
(1)配平步骤I反应的化学方程式:
____Ca5(PO4)3F+ ____C+ ____SiO2=____SiF4↑+ ___P4+____CO↑+____CaSiO3。其中氧化剂是______。
(2)湿法中粉碎氟磷灰石的目的是___________。
(3)浸取槽中发生反应的化学方程式________;浸取槽不能使用玻璃器皿的原因___________。
(4)探究中发现,65℃、一定流速下鼓气(鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出),并通过控制盐酸的用量减少后续除氟工艺。其他条件不变,盐酸实际用量/理论用量与所得的磷酸中氟含量及磷酸的浸取率如图所示。

①选择盐酸用量:盐酸实际用量/理论用量的范围为________(填字母代号)时磷酸浸取率较高且氟含量较低。
A.0.95~1.00 B.1.00~1.05
C. 1.05~1.10 D.1.15~1.20
②盐酸稍过量,氟含量降低的原因是___________。
③盐酸过量较多,氟含量快速增加的可能原因是___________。
(5)通过双指示剂方法测定浸取液中盐酸和磷酸的浓度。实验如下:每次取10.0mL浸取液,用1.0 mol·L-1NaOH溶液滴定,分别用不同的指示剂,滴定结果见表。含磷微粒在不同pH下物质的量分数如图所示。(甲基橙的变色范围为3.1~4.4,百里酚酞的变色范围为9.4~10.6)


则浸取液中c(HCl)=___________mol·L-1。
【答案】4 30 21 1 3 30 20 Ca5(PO4)3F 增大接触面积,提高反应速率,提高浸取率 Ca5 (PO4)3 F +10HCl=3H3PO4+5CaCl2+HF 玻璃会被氢氟酸腐蚀 C 氢氟酸为弱酸,酸稍过量,抑制其电离,形成气体逸出 随着酸过量较多,反应速率加快,产生大量的泡沫,不利于HF的逸出 2.17
【解析】
(1)氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,根据氧化还原反应的规律书写并配平方程式;
(2)流程中将氟磷灰石粉碎,可增大氟磷灰石与稀硫酸反应的接触面积,据此分析解答;
(3)氟磷灰石、浓盐酸在浸取槽中复分解反应,结合生成的性质分析解答;
(4)①根据图像,分析所得的磷酸中氟含量及磷酸的浸取率较高且氟含量较低的盐酸实际用量/理论用量;
②氢氟酸为弱酸,根据影响弱电解质电离的因素分析解答;
③根据题意,减少反应过程中液面的泡沫,利于HF逸出,据此分析解答;
(5)根据含磷微粒在不同pH下物质的量分布图,在pH=4左右时,溶液中主要以H2PO4-存在,在pH=10左右时,溶液中主要以HPO42-存在,分析判断用10 mol·L-1NaOH溶液滴定浸取液中盐酸和磷酸的浓度过程中,用甲基橙作指示剂和用百里酚酞作指示剂时发生的反应,然后列式计算。
(1)氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为4Ca5P3FO12+30C +21SiO2![]() SiF4↑+3P4+ 30CO↑+20CaSiO3,反应中C的化合价升高,C为还原剂,Ca5P3FO12中P元素的化合价降低,Ca5P3FO12为氧化剂,故答案为:4;30;21;1;3;30;20;Ca5P3FO12;
SiF4↑+3P4+ 30CO↑+20CaSiO3,反应中C的化合价升高,C为还原剂,Ca5P3FO12中P元素的化合价降低,Ca5P3FO12为氧化剂,故答案为:4;30;21;1;3;30;20;Ca5P3FO12;
(2)流程中将氟磷灰石粉碎,可增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率,提高浸取率,故答案为:增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率,提高浸取率;
(3)根据湿法流程图,氟磷灰石、浓盐酸在浸取槽中复分解反应,反应的化学方程式为Ca5 (PO4)3 F +10HCl=3H3PO4+5CaCl2+HF,反应生成了氢氟酸,氢氟酸能够腐蚀玻璃,因此浸取槽不能使用玻璃器皿,故答案为:Ca5 (PO4)3 F +10HCl=3H3PO4+5CaCl2+HF;玻璃会被氢氟酸腐蚀;
(4)①根据图像,盐酸实际用量/理论用量为1.05~1.10时所得的磷酸中氟含量及磷酸的浸取率较高且氟含量较低,故选C;
②盐酸稍过量,即盐酸实际用量/理论用量稍大于1,由于氢氟酸为弱酸,酸稍过量,抑制其电离,形成气体逸出,导致氟含量降低,故答案为:氢氟酸为弱酸,酸稍过量,抑制其电离,形成气体逸出;
③根据题意,鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出,当盐酸过量较多时,反应速率加快,产生大量的泡沫,反而不利于HF的逸出,会造成氟含量快速增加,故答案为:随着酸过量较多,反应速率加快,产生大量的泡沫,不利于HF的逸出;
(5)根据含磷微粒在不同pH下物质的量分布图,在pH=4左右时,溶液中主要以H2PO4-存在,在pH=10左右时,溶液中主要以HPO42-存在,因此用10 mol·L-1NaOH溶液滴定浸取液中盐酸和磷酸的浓度过程中,用甲基橙作指示剂时,氢氧化钠与盐酸反应生成氯化钠,与磷酸反应生成磷酸二氢钠,用百里酚酞作指示剂时,氢氧化钠与磷酸二氢钠反应生成磷酸一氢钠。
设盐酸的浓度为x,磷酸的浓度为y,则有y×0.01L=(0.0329-0.0273)L×1.0 mol/L,0.0273L×1.0 mol/L= y×0.01L+x×0.01L,解得x=2.17 mol/L,y=0.56 mol/L,故答案为:2.17。